工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。
(6分) 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。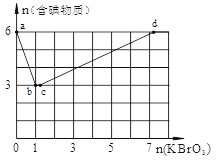
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式 ________。
(3)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中可能观察到的现象为 。
汞不溶于水,易挥发,易与许多金属形成合金,汞是对人体危害较大的一种金属,据统计世界上有80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们的重视,水体中的无机汞主 要有Hg2+、Hg22+。
(1)实验时倘若不慎,将汞溅落地面时,可先用涂上X溶液的锌片去粘拾,然后再用足量的X溶液 溶解锌片回收汞,X溶液可以是 (填试剂名称)
(2)检测水体中的Hg2+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为
(3)冶金厂治理含汞、含硫的烟气并回收汞,中国冶金工作者在研究“Hg-I-H2O”系热力学的基础上,查明KI溶液能有效吸收汞,吸收总反应为:2Hg+SO2+8I-+4H+ =2HgI42-+S+2H2O,最后进行电解法电解吸收液(K2HgI4),阴极的电极反应式为
(4)国家制定的工业废水排放标准:汞的含量≤0.05 mg/L。某合作学习小组的同学拟用硫化钠法处理含汞废水,其步骤为:先将溶液pH调至8~10,然后加入稍过量的硫化钠溶液,最后加入一定量的FeSO4溶液,过滤后排放。已知:25℃HgS的Ksp= 4×10-52;Hg2S的Ksp=1.0×10-47,FeS 的Ksp=6.3×10-18;HgS+Na2S Na2HgS2(易溶)。
Na2HgS2(易溶)。
①若操作程序完全正确,且废水中只含无机汞,上述处理后的废水能否达标排放 (选填:“能”或“不能”)
②加入FeSO4溶液的作用(写出两项)
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。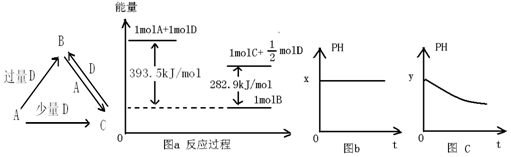
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 。
②反应B+A→C的离子方程式为 。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为 (填化学式),此时图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);已知图c中y﹤7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是 。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式: 。
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式) 。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程 。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式 。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式 。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为 ;若B为常见家用消毒剂的主要成分,则B的化学式是 。
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是 ;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,H2SO4溶解Al2O3的离子方程式为:______________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:_______________________。
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:__________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是________________________、________________________。
【化学—选修2化学与技术】聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:

(1)水是生命之源,水质优劣直接影响人体健康. 天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是 。水的净化与软化的区别是 。
(2)“碱溶”时,发生反应的化学方程式为 。“滤渣Ⅰ”成分是_________。
(3)“酸溶Ⅱ”时,可以产生Fe2+的反应的离子方程式为 。
(4)“氧化”时应控制在比较低的温度下进行,原因是 。
(5)“氧化”时若用ClO2代替,发生反应的离子方程式是 。
【化学—选修2化学与技术】
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是_________________________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因_____________________。
(3)②中反应后无气体放出,该反应的离子方程式为____________________________。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因
现有A、B、C、D、E五种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 |
性质 |
| A |
该元素的最外层电子数是次外层电子数的2倍 |
| B |
该元素形成的最简单氢化物常用作制冷剂 |
| C |
该元素是电负性最大的元素 |
| D |
该元素的一种氧化物具有磁性 |
| E |
E+原子核外有3层电子且各层均处于全满状态 |
根据以上信息,回答下列问题:
(1)A、B、C三种元素的第一电离能由大到小的顺序是 (用元素符号表示);E基态原子价电子电子排布式是__________。
(2)BC3分子的空间构型为 ,B和C两元素的氢化物的沸点相比较,较高的是 (写分子式)
(3)一定条件下,A元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有______个A原子。

(4)图2为D元素的单质形成的某种晶体的晶胞结构,已知该晶体的密度为a g/cm3,NA为阿伏加德罗常数的值,则该晶胞的体积为_________cm3。
(5)向E的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):





 请回答
请回答 (1)混合物中是否存在FeCl2_________(填“是”或“否”);
(1)混合物中是否存在FeCl2_________(填“是”或“否”); (2)混合物中是否存在(NH4)2SO4_____(填“是”或“否”),你的判断依据是_______。
(2)混合物中是否存在(NH4)2SO4_____(填“是”或“否”),你的判断依据是_______。 (3)写出反应⑤的离子反应方程式;___________________________________。
(3)写出反应⑤的离子反应方程式;___________________________________。 (4)请根据图中数据分析,原固体混合物的成分为
(4)请根据图中数据分析,原固体混合物的成分为 _____________________(写化学式)。
_____________________(写化学式)。
短周期元素X、Y、Z、Q在元素周期表中的相对位置如下图,地壳中含量最高的元素已包含其中。
| |
|
Y |
|
Q |
|
| X |
|
|
|
|
Z |
回答下列问题:
(1)Q在元素周期表中的位置是 。X离子的结构示意图为 。
(2)下列选项中,能证明元素非金属性Z强于Y的是 。
A.反应中,Y原子得到的电子数比Z原子得到的电子数多
B.最高正价,Z比Y的高
C.最高价氧化物的水化物酸性:Z>Y
(3)ZQ2是国际公认高效安全杀菌消毒剂,已知ZQ2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ZQ2被还原为Z—,该反应的离子方程式为 。
(4)H元素与Y形成的化合物中二者的质量之比是1:3,已知常温下4g该化合物完全燃烧并恢复到原来温度时放出222.6kJ热量,则表示该化合物燃烧热的热化学方程式为_________________。
(5)表中X的最高价氧化物对应水化物的化学式为X(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,则其饱和溶液中的pH =_____(已知:T℃,Ksp[Y(OH) n]=4.0×l0-12;lg5=0.7)。
下列离子方程式不正确的是 ( )
A.溴乙烷在氢氧化钠水溶液中的反应:CH3CH2Br + OH- CH3CH2OH +Br- CH3CH2OH +Br- |
B.醋酸溶液与氢氧化铜反应:2CH3COOH + Cu(OH)2 Cu2+ + 2CH3COO-+ 2H2O Cu2+ + 2CH3COO-+ 2H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+ CO2 + H2O 2C6H5OH + CO32- 2C6H5OH + CO32- |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+4[Ag(NH3)2]++4OH- CO32-+2NH4+ +4Ag↓+6NH3+2H2O
CO32-+2NH4+ +4Ag↓+6NH3+2H2O
Ⅰ.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号) 。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是 (填代号)。
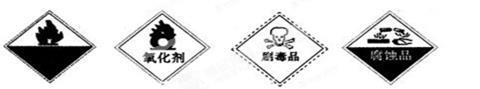
A.自燃物品 B.氧化剂 C.剧毒品 D.腐蚀品
Ⅱ某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4,溶液立即变蓝;
实验②:向实验①的溶液中加入4 L 0.5 mol/L的Na2SO3溶液,发生反应如下
SO32-+ I2+H2O→SO42-+I-+H+(未配平),恰好完全反应。
(1)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)写出实验①中发生反应的离子方式 。
试用化学方法除去下列物质中混有的少量杂质,要求除杂试剂均过量,若为溶液中的离子反应请写出其离子方程式,否则写化学方程式。并写出相应的分离方法。
(1)除去FeCl2溶液中混有的少量FeCl3;方程式: ______________ 。分离方法:______
(2)除去CO2气体中混有的少量HCl;方程式:_______________。分离方法:______
(3)除去NaCl溶液中混有的少量NaBr;方程式:__________________。分离方法:______
某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在________范围之间。
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式__________。