(8分,每空2分)用MnO2和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,回答下列问题:
(1)写出用MnO2和浓盐酸反应制Cl2的离子方程式:
(2)计算生成Cl2的体积是多少L(标准状况下)?
(3)写出生成漂白粉的化学反应方程式 ,
利用生成的Cl2可制得漂白粉的质量是 克。
已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
请填空:
(1)反应①的化学方程式是 。
(2)反应④的离子方程式是 。
(3)写出反应③的化学方程式并标明电子转移方向及数目 。
(4)设计实验证明反应③的气体产物中既有B,又有C,可将气体依次通过:溶液Ⅰ、酸性高锰酸钾溶液、溶液Ⅰ、溶液Ⅱ,则溶液Ⅰ和溶液Ⅱ分别为(填试剂名称): 、 ,实验中两次使用溶液Ⅰ的作用分别是 , 。
(5)在工业生产上规定:空气中C的最大允许排放浓度不得超过0.02mg/L。
某同学拟用下列简易装置测定空气中C的含量:准确移取50mL 1×10-4mol/L的标准碘水溶液,注入下图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。反应中碘发生的变化为I2→HI。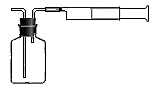
①写出C与碘水反应的化学方程式 ;
②若测得抽气次数为100,则空气中C的含量为 mg/L;
③乙同学抽气的次数至少为 次,方可说明该地空气中C的含量符合排放标准。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是________溶液,乙是_________溶液。
(2)实验②中所发生反应的离子方程式为_____________________________。
(3)甲溶液的物质的量浓度为,乙溶液的物质的量浓度为___________________。
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是____________________________________。
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为_______________________;
,常用作脱氯剂,该反应的离子方程式为_______________________;
(2)酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式: ________________。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式: ________________、_________________。
(4)向含有n mol 溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式: 。
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题:
(1)甲池中碳极上电极反应式是________________,甲池铁极上电极反应属于 。(填“氧化反应”或“还原反应”)
(2)写出乙池中总反应的离子方程式______________________。
(3)将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为______________________________。
已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)离子方程式分别为:反应② ;
⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2S04溶解A1203的离子方程式是
KMnO4 - 氧化Fe2+的离子方程式补充完整:

(3)已知:
生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2,
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 .
② Ⅳ 中加入MnS04的目的是
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。
(2)反应②中还原剂是 。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。
① 炉渣碱浸时反应的离子方程式是 、 。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]  2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
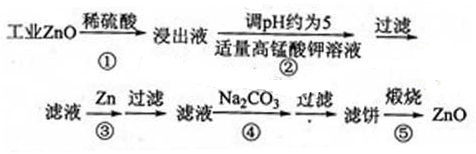
提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为 ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是 。
(2)反应③的反应类型为 ,过滤得到的滤渣中,除了过量的锌外还有 。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是 。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x等于 。
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。

(1)写出反应②和④的离子方程式
② 。
④ 。
(2)溶液中含有的离子是 ,它们的物质的量浓度之比为 。
废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。
(2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题。
(1)工业上可用Cu2S+O2 2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:________________.CuSO4溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,则反应后的溶液中肯定有的离子是________________;若有红色固体,则反应后的溶液中肯定没有的离子是________,检验该离子的试剂为________。
(4)铁氰化钾 K3[Fe(CN)5]和亚铁氰化钾K4[Fe(CN)6] 的混合溶液可用于太阳能电池的电解液,该太阳能电池的工作原理示意图如图所示,其中催化剂a为________极,电极反应式为________;