(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
(1)重铬酸钾(K2Cr2O7)是一种应用广泛的强氧化剂,它常用铬铁矿(主要是FeO、Cr2O3)在氯酸钾的氧化下制备出K2CrO4 ,将K2CrO4溶于稀硫酸酸化得到重铬酸钾溶液,请写出酸化K2CrO4制备K2 Cr2 O7溶液的平衡离子方程式: , 这一过程溶液的颜色从 到 。
(2)酒驾检测时,酸性的K2Cr2O7将乙醇氧化成乙酸,同时自身还原成绿色的离子,涉及的离子方程式 为: 。
(3)TiCl4遇到高温水蒸气就会水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2,为什么水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 检验TiO2·x H2O中Cl-是否被洗净的方法是______________________________
(4)将铜片放入浓氨水,无任何现象,加入一定量的H2O2后,铜片缓慢溶解,并形成深蓝色的溶液,写出相应的离子方程式: 。
(共10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________ 。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式_______________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
(10分)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。请回答下列问题: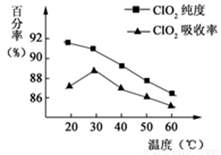
(1)由图可知,反应时需要控制的适宜温度是 ℃。
(2)黄铁矿中的硫元素在酸性条件下被ClO3—氧化成SO42—,写出制备二氧化氯的离子方程式 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得500mLClO2溶液,取出25.00mL,加入42.00mL0.500mol·L—1(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500mol·L—1K2Cr2O7标准溶液滴定至终点,消耗20.00mL。反应原理如下:
4H++ClO2+5Fe2+==Cl—+5Fe3++2H2O
14H++Cr2O72—+6Fe2+ ==2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(请写出计算过程)。
I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是_____________________________ 。在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是_______________________ _。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为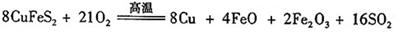
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为氧化物,则A与水反应的化学方程式为 ,该反应中氧化剂和还原剂的物质的量之比为 .
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为 .
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为 .
(2)若E为单质气体,D为白色沉淀,B含有的化学键类型为 ,C与X反应的离子方程式为 .
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则该可逆反应的化学方程式为 .
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)A是 ,G是 。(用化学式填写)
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液的反应生成I和D的离子方程式是 。
(5)向H溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,但该反应中没有放出E气体,则该反应的离子方程式 。
(6)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:则物质I的物质的量为_______________mol。
根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
(1)A的化学式为 ; F的化学式为 ;
(2)反应 ③的化学方程式: ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为: 。
Ⅰ.甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示:
(1)取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙)。(1)所以是 。
(2)甲是 ,设计实验确定甲的物质组成 (若乙物质组成确定,则此空不填)。
Ⅱ.有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大。将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、 、
、 、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是________。
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种盐的化学式分别是A________,B________,C________。
(3)不需要加入任何试剂就能将上述三种盐溶液区分开来,鉴别出来的先后顺序为____________ (填化学式)。
(4)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、 、
、 、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种盐的物质的量之比为________,若向溶液中加入过量Ba(OH)2,发生反应的总离子方程式为 。
、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种盐的物质的量之比为________,若向溶液中加入过量Ba(OH)2,发生反应的总离子方程式为 。
(1)已知0.1mol/L的NaHSO4溶液中H+ 的物质的量浓度为0.1mol/L,请回答下列问题:
①写出NaHSO4在水溶液中电离的方程式:___________________________________。
②若将NaHSO4与Ba(OH)2在溶液中按物质的量比为2:1混合,反应的离子方程式是:___________________________________________________________。
若将NaHSO4与Ba(OH)2在溶液中按物质的量比为1:1混合,反应的离子方程式是:___________________________________________________________。
(1)在Na+浓度为0.9mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出1.12L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为3.6g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:(1)实验I能确定一定不存在的离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
|
|
|
|
(4)判断K+是否存在,若存在求其最小浓度_______,若不存在说明理由________ 。
(5)Ⅰ、溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr =" 2NaCl" + Br2,该反应被氧化的元素为 (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 个。
Ⅱ、请按要求书写化学方程式或离子方程式。
(1)小明运用化学实验证明了久置于空气中的亚硫酸钠已变质,请用化学方程式表示亚硫酸钠变质的原因 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式 ;然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 _。
(1)实验室中常用加热分解氯酸钾制取氧气,写出反应的化学方程式,并用双线桥法标出电子转移情况: 。
(2)实验室制取Cl2的反应方程式之一为: 。
。
被氧化的盐酸占反应盐酸总量的 ;
当标准状况下有11.2L氯气生成时,该反应的电子转移数为 。
(3)已知下列两个氧化还原反应:O2+4HI===2I2+2H2O 及Na2S+I2===2NaI+S,则三种单质的氧化性顺序为:
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式: ;在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式: 。
(5)医疗上常用小苏打治疗胃酸过多,小苏打溶液与盐酸反应的离子方程式为: 。
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Na+、Al3+、Ba2+、NH4+ |
| 阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
(12分)亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式 。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为 。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(3)吸收塔内的温度不能过高的原因为 。
(4)ClO2被S 还原为ClO
还原为ClO 、Cl
、Cl 转化率与pH关系如图。
转化率与pH关系如图。
写出pH≤2时ClO2与S 反应的离子方程式: 。
反应的离子方程式: 。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN 等有明显的去除效果。某工厂污水中含CN
等有明显的去除效果。某工厂污水中含CN amg/L,现用ClO2将CN
amg/L,现用ClO2将CN 氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
.铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,
PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;
PbO2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为_ _。若电解液中不加入Cu(NO3)2,主要缺点是 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(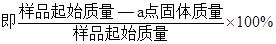 )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。