(1)①1.5molH2SO4的质量是____________;
②9.03×1023个氨分子中的质子物质的量是_________;
③标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为_______________;
④71.5g碳酸钠晶体(Na2CO3·10H2O)溶于水,配成500ml溶液,此溶液的物质的量浓度为______________。
(2)现有①铁片 ②饱和食盐水 ③液态氯化氢 ④乙醇 ⑤干冰 ⑥熔融KNO3⑦BaSO4固体⑧石墨 ⑨苛性钠,其中属于电解质的是_______________,属于非电解质的是__________,能导电的是_____________________
(3)写出下列反应的离子反应方程式:
①少量二氧化碳通入澄清石灰水中:____________________________________________
②向硫酸氢钠溶液中不断加入氢氧化钡溶液至沉淀完全:__________________________
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子中的一种或几种.当向该溶液中加入一定物质的量的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示.
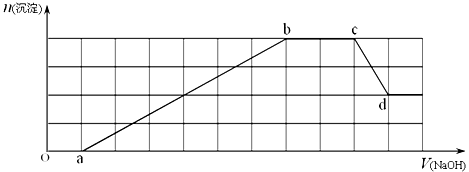
(1)原溶液中一定含有____________,一定不含有____________;
(2)cd段发生的离子反应为___ _________;
(3)原溶液中物质的量浓度最大的阳离子与原溶液中的阴离子的物质的量之比为__________________.
(8分)某固体混合物可能由KCl、NaNO3、K2SO4、FeCl3、CaCl2、K2CO3中的一种或几种混合而成,为鉴定其组成,依次进行如下实验:
(1)混合物中加入足量水得到无色透明溶液;用铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色;
(2)上述溶液中滴加BaCl2有白色沉淀产生;
(3)过滤,然后向上述白色沉淀中加盐酸时,沉淀全部溶解;
(4)往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸。
试判断:肯定存在的物质有____________;肯定不存在的物质有_______________________;可能存在的物质有______________________;写出第(4)步实验中发生反应的离子方程式:_____________________。
已知实验室制取C12的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。若加热分解后所得到的固体全部为Pb3O4,现将a molPbO2加热分解,则加热过程中放出O2_____L(标准状况下);
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4+2CH3COONH4= (CH3COO)2Pb+(NH4)2SO4。
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑
④X+Ca(OH)2―→Y+CaCO3↓
回答下列问题:
(1)W、Y、Z的化学式分别是:W:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式)
(3)若④反应在溶液中进行,写出其离子方程式
除去括号内的杂质,写出除杂的试剂,并写出溶液中反应的离子方程式。
(1)FeSO4(CuSO4)试剂 ,离子方程式__________________。
(2)CO2 (HCl) 试剂 ,离子方程式____________________。
(3)Cu(CuO)试剂 ,离子方程式_______________________。
在过量FeSO4溶液中加入稀硫酸,再滴入几滴NaClO溶液,溶液立即变黄。
(1)上述反应的离子方程式为____________________________。
(2)为检验上述反应中的氧化产物,取少许上述反应后的溶液,加入KSCN溶液,溶液变红,证明氧化产物为Fe3+;为检验上述反应中的还原产物,请填写实验操作、现象和匹配的结论:取少许上述反应后的溶液,______________________________。
(3)为证明上述反应后的溶液中仍存在过量的Fe2+,可向其中滴加_______________溶液。
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
试根据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是__________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式__________,制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓) __________。
(3)还原过程中加入少量盐酸的作用是__________,加入NaCl且过量的原因是__________。
(4)合成结束后所得产品用酒精淋洗的目的是__________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式__________。
烟气中主要污染物为SO2、NO、NO2,可用如下工艺进行脱硫脱硝及产物回收。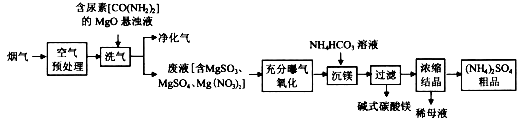
(1)空气预处理过程中,发生主要反应的化学方程式为____________________________。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体是_________________(填化学式)。
(3)充分曝气氧化过程中,发生反应的化学方程式为___________________。
(4)完成沉镁过程中生成碱式碳酸镁[MgCO3∙Mg(OH)2]的离子方程式
______Mg2++______= MgCO3∙Mg(OH)2↓+______CO2↑+______H2O
(5)(NH4)2SO4粗品中含有的主要杂质为__________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为________________。
①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是 (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是 。
(2)写出HCl的电离方程式 。
(3)写出过氧化钠与水反应的化学方程式___________________________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________。
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式_______________________。
在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g) Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为: 。
④原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。

①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。

①阳极的电极反应式为
②简述浓缩室中得到浓乳酸的原理:
③电解过程中,采取一定措施可控制阳极室pH约为6-8,此时进入浓缩室的OH-可忽略不计。
400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g• mol-1)
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和SiO2等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:

(1)实验室实现“操作I”所用的玻璃仪器有玻璃棒、 和烧杯;
(2)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 ,检验“酸溶”后的溶液中含有Fe2+的试剂及现象是 ;
(3)“操作Ⅲ”系列操作名称依次为 、冷却结晶、过滤和洗涤。洗涤沉淀的方法是 ;
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右(写出最佳答案)

(1)沉淀1的化学式是 ,试剂C的名称是 ,分离出沉淀2的操作名称是 ;
(2)写出混合液+A的离子方程式
生成沉淀2的离子方程式
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题:
(1)物质C、E分别为 、 。(填名称)
(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为 。
(3)反应②的离子方程式为 。
(4)新配制的F溶液应加入________以防止其转化为G。请设计实验检验F、G的混合溶液中F的金属阳离子。(写出试剂、操作、现象、结论) 。