吉林省长春外国语高一上第二次月考化学试卷
下列各项所述的关系正确的是
| A.有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外观表现 |
| B.一种物质被氧化,必然有另一种物质被还原 |
| C.被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 |
| D.氧化剂在反应中被氧化,还原剂在反应中被还原 |
已知有反应BrO3-+5Br-+6H+===3Br2+3H2O。下列反应中从反应原理来看与该反应最相似的是
A.2KNO3 2KNO2+O2↑ 2KNO2+O2↑ |
B.NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
| C.3NO2+H2O===2HNO3+NO |
| D.SO2+2H2S===3S↓+2H2O |
实验室制Cl2反应为4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O,下列说法不正确的是
MnCl2+Cl2↑+2H2O,下列说法不正确的是
| A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1mol Cl2,转移电子的物质的量为2mol |
| C.每消耗1mol MnO2,起还原剂作用的HCl消耗4mol |
| D.转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L |
在反应3S + 6KOH === 2K2S + K2SO3 + 3H2O中,被还原的硫与被氧化的硫的物质的量的比是
| A.2:1 | B.1:2 | C.3:1 | D.1:3 |
常温下,在溶液中可发生以下反应:①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2;下列说法错误的是
| A.铁元素在反应①和③中均被氧化 |
| B.反应②中当有1mol Cl2被还原时,有2mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2>Br2>Fe3+>I2 |
| D.还原性强弱顺序为:I->Fe2+>Br->Cl- |
将一小块钠投入到FeCl3溶液中,观察到的现象是
| A.钠溶解,有铁析出并有气体产生 | B.只有气体产生 |
| C.既有气体产生,又有红褐色沉淀产生 | D.只有沉淀产生 |
下列反应的离子方程式书写正确的是
| A.钠和冷水反应:Na+2H2O===Na++2OH-+H2↑ |
| B.金属铝溶于氢氧化钠溶液:Al+2OH-===AlO2-+H2↑ |
| C.金属铝溶于盐酸中:2Al+6H+===2Al3++3H2↑ |
| D.铁跟稀硫酸反应:2Fe+6H+===2Fe3++3H2↑ |
在500 mL NaOH溶液中加入足量铝粉,反应完成后共收集到标准状况下的气体33.6L,该NaOH溶液的浓度为
| A.1mol/L | B.1.5 mol/L | C.2 mol/L | D.3 mol/L |
用铝箔包裹0.1mol金属钠,用针刺出一些小孔,放入水中,完全反应后,产生的气体的体积为(标准状况)
| A.小于1.12L | B.1.12L |
| C.在1.12L和4.48L之间 | D.大于4.48L |
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体,下列区分这两种物质的方法中正确的是
| A.分别用砂锅加热两种样品,全部分解挥发没有残留物的是小苏打 |
| B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打 |
| C.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打 |
| D.将样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下以性质错误的是
| A.溶液显碱性 |
| B.与澄清石灰水反应产生白色沉淀 |
| C.与足量盐酸反应产生气体 |
| D.受热易分解 |
2.3g纯净物金属钠在干燥空气中被氧化后得到3.5g固体,由此可判断其氧化产物是
| A.只有Na2O | B.只有Na2O2 |
| C.Na2O和Na2O2 | D.无法确定 |
用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是
| A.只含有Na+ | B.一定含有Na+,可能含有K+ |
| C.既含有Na+,又含有K+ | D.可能含有Na+,可能还会有K+ |
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则淀淀消失;若将丁溶液滴入甲溶液中,无明显现象发生,据此可推断丙物质是
| A.Al2(SO4)3 | B.BaCl2 |
| C.NaOH | D.FeSO4 |
下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是
| A.Na+、NO3-、AlO2-、SO42- | B.Na+、Al3+、NO3-、SO42- |
| C.K+、Cl-、AlO2-、CO32- | D.Na+、Mg2+、Cl-、HCO3- |
将浓度均为0.1mol/L的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是
| A.BaCl2 NaOH NaHCO3 | B.AlCl3 NH3·H2O NaOH |
| C.Ba(OH)2CaCl2Na2SO4 | D.Na2CO3 MgCl2 H2SO4 |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是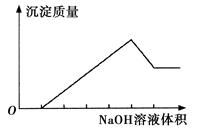
| A.Mg2+、Al3+、Fe2+ |
| B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ |
| D.只有Mg2+、Al3+ |
相同物质的量的Fe、Mg、Al、Na各0.1 mol投入到含HCl 0.01 mol的稀盐酸中,置换出H2由多到少的顺序是
| A.Al>Mg=Fe>Na | B.Al=Mg=Fe=Na |
| C.Na>Al>Mg>Fe | D.Al=Mg=Fe<Na |
有镁铝混合粉末10.2 g,将它溶于500mL 4mol·L-1的盐酸中,若要使沉淀的质量最大,则需加入2mol·L-1的氢氧化钠溶液的体积是
| A.1000mL | B.500 mL | C.100 mL | D.1500 mL |
A、B、C是中学化学中常见的单质,常温下甲、乙两种化合物分别是黑色固体和无色液体,这些化合物和单质之间有如图所示关系。据此判断: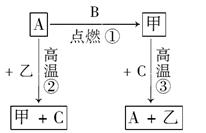
(1)元素A有可变化合价,则单质A是________,化合物甲是________。
(2)写出反应①②③的化学方程式
“绿色试剂”双氧水可作为采矿业废液的消毒剂,可消除采矿废液中的氰化物(如:KCN),化学方程式:KCN+H2O2+H2O===A+NH3↑
(1)生成物A的化学式为________。
(2)在标准状况下有0.448L氨气生成,则转移的电子数为________。
(3)反应中被氧化的元素为________。
(4)H2O2被称为绿色氧化剂的理由是____________ ________。
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑
④X+Ca(OH)2―→Y+CaCO3↓
回答下列问题:
(1)W、Y、Z的化学式分别是:W:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式)
(3)若④反应在溶液中进行,写出其离子方程式
某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2+、K+杂质离子并
尽可能减少AlCl3的损失。回答下列问题: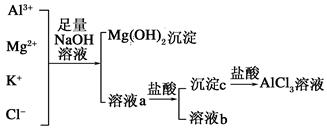
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:________________
(2)氢氧化钠溶液能否用氨水代替,为什么?______ __________。
(3)溶液a中存在的阴离子有_____ ___;在溶液a中加入盐酸时需控制盐酸的量,为什么______________为此,改进的方法是将盐酸改成通入 气体。
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中的试剂为
(2)B中发生反应的化学方程式为
(3)若实验用铝镁合金的质量为ag,测得 氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为cg,则铝的质量分数为 ,铝的相对原子质量为____________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”或“不受影响”)
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如下图所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是______(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:________ ______
(3)与实验Ⅲ相比,实验Ⅳ的优点是________(填选项序号)。
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(4)Ⅲ中加热碳酸氢钠时,澄清石灰水会变浑,石灰水变浑反应的离子方程式
(5)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入物固体最好是________(填化学式)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号