有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W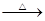 X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑
④X+Ca(OH)2―→Y+CaCO3↓
回答下列问题:
(1)W、Y、Z的化学式分别是:W:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式)
(3)若④反应在溶液中进行,写出其离子方程式
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W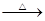 X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑
④X+Ca(OH)2―→Y+CaCO3↓
回答下列问题:
(1)W、Y、Z的化学式分别是:W:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式)
(3)若④反应在溶液中进行,写出其离子方程式