某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如下图所示。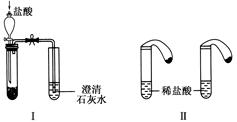
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是______(填装置序号)。
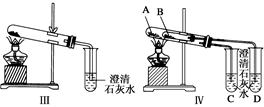
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:________ ______
(3)与实验Ⅲ相比,实验Ⅳ的优点是________(填选项序号)。
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(4)Ⅲ中加热碳酸氢钠时,澄清石灰水会变浑,石灰水变浑反应的离子方程式
(5)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入物固体最好是________(填化学式)





 粤公网安备 44130202000953号
粤公网安备 44130202000953号