在学习中,我们经常应用类推法。下列左边正确,类推法应用于右边也正确的是
| AA |
向FeCl2溶液中滴入氯水 2Fe2++ Cl2= 2Fe3++ 2Cl— |
向FeCl2溶液中滴入碘水 2Fe2++ I2= 2Fe3++2I— |
| B |
CO2通入漂白粉溶液中 CO2+ Ca2++2ClO—+H2O=CaCO3↓+ 2HClO |
SO2通入漂白粉溶液中 SO2 +Ca2++2ClO—+H2O=CaSO3↓+2HClO |
| C |
向Na2CO3溶液中滴入稀HNO3 CO32—+ 2H+ = CO2↑+ H2O |
向Na2SO3溶液中滴入稀HNO3 SO32— +2H+ = SO2↑+H2O |
| D |
向澄清石灰水中通入少量CO2气体 Ca2++2OH— +CO2= CaCO3↓+ H2O |
向澄清石灰水中通入少量SO2气体 Ca2++2OH— +SO2= CaSO3↓+H2O |
下列各组离子可能大量共存的是
A.pH=1的溶液中: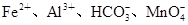 |
B.能与金属铝反应放出氢气的溶液中: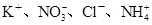 |
C.含有大量OH-的无色溶液中: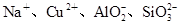 |
D.常温下水电离出的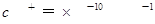 的溶液中: 的溶液中: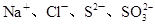 |
下列反应的离子方程式正确的是
| A.往硝酸银溶液中滴加少量氨水:Ag++2NH3==[Ag(NH3)2]+ |
B.尼泊金酸( )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: +2HCO3— → +2HCO3— → + CO2↑+2H2O + CO2↑+2H2O |
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH- CH3COO-+NH4++2Ag↓+3NH3+H2O CH3COO-+NH4++2Ag↓+3NH3+H2O |
| D.苯酚钠溶液中通入CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
下列离子反应方程式正确的是( )
| A.小苏打溶液中加入过量石灰水2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
| B.苛性钾溶液中加入稀醋酸H++OH-=H2O |
| C.氯化亚铁溶液中通入氯气Fe2++Cl2=Fe3++2Cl- |
| D.氯化铝溶液中加入过量氨水Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
下列叙述正确的是
| A.常温时,某溶液中由水电离出来的c(H+)和c(OH一)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、A1O2-、SO42一 |
| B.常温时,0.1 mol/lHA溶液的pH>1,0.1 mol/lBOH溶液中c(OH一)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为c(B+)>c(OH一)>c(H+)>c(A一) |
| C.过量SO2通入到Ba(NO3)2溶液中,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaS04 +2NO +4H+ |
| D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb |
下列反应的离子方程式书写正确的是
| A.电解氯化镁溶液: 2Cl- + 2H2O="====" Cl2 ↑+ H2↑+ 2OH- |
| B.向AlCl3溶液中加入过量的氨水: Al3+ + 4NH3·H2O=====AlO2-+ 4NH4++ 2H2O |
| C.Cu与浓硝酸反应制备NO2: 3Cu+ 8H+ + 2NO3-=====3Cu2+ + 2NO2↑+ 4H2O |
| D.向KAl(S04)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3+ + 2SO42- + 2Ba2+ + 4OH-=====AlO2-+ 2BaSO4 ↓+ 2H2O |
下列离子方程式书写正确的是( )
| A.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B.碳酸钠溶液与硫酸氢钠溶液反应:CO32-+H+=CO2↑+H2O |
| C.Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D.向FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
能正确表示下列反应的离子方程式是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O |
| B.NaHSO3溶液中通入少量Cl2:HSO3- + Cl2+ H2O=3H+ +SO42- +2Cl- |
C.氯化钠与浓硫酸混合加热:H2SO4+2Cl- SO2↑+Cl2↑+H2O SO2↑+Cl2↑+H2O |
| D.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
下列离子方程式正确的是
| A.向明矾溶液中加入氢氧化钡溶液至沉淀的物质的量达到最大值: Al3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ AlO2-+2H2O |
| B.向澄清石灰水中通入少量CO2:OH- + CO2=HCO3- |
| C.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2CH3COOH=Ca2++ 2CH3COO-+H2O + CO2↑ |
| D.硝酸银溶液中加入铜粉:Ag+ + Cu=Cu2+ + Ag |
下列离子方程式正确的是( )
| A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B.将Na块投入水中,产生气体:Na+2H2O=Na++2OH-+H2↑ |
| C.0.1 mol·L-1亚硫酸氢钠溶液的pH约为3:HSO3-+H2O=SO32-+H3O+ |
| D.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
能正确表示下列反应的离子方程式是
A.硫氢化钠的水解反应 HS-+ H2O  S2-+H3O+ S2-+H3O+ |
| B.碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-= CaCO3↓+2H2O+CO32- |
| C.Na2O2与H2O反应制备O2 Na2O2 + H2O = 2Na+ + 2OH-+ O2↑ |
| D.向碳酸钠溶液中加少量盐酸 CO32-+2H+ = H2O+CO2↑ |
现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
已知:①E、F两溶液呈碱性;G、M、N 溶液呈酸性。
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失。
③M溶液与另外四种溶液反应都能产生沉淀。
下列说法正确的是( )
A.N溶液与过量的F溶液反应的离子方程式为: Ba2+ + SO42- = BaSO4↓
B.E溶液与N溶液混合发生反应的离子方程式为:2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+ 3CO2↑
C.M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中
D.将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为
2H+ + CO32- = CO2↑+ H2O
下列离子方程式书写及评价合理的是
| |
离子方程式 |
评价 |
| A |
Mg(HCO3)2溶液中加入足量的NaOH溶液Mg2++2HCO3-+2OH-=MgCO3↓+ CO32-+ 2H2O |
正确,NaOH过量,酸式盐与碱完全反应生成正盐和水; |
| B |
1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合2AlO2-+5H+ =Al3+ +Al(OH)3↓+H2O |
正确,AlO2-与H+按物质的量1:1反应转化为Al(OH)3,过量的H+再将一半Al(OH)3转化为Al3+ |
| C |
将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8 H+= Fe2+ + 2Fe3+ + 4H2O |
正确,Fe3O4化学式可改写为FeO·Fe2O3,Fe2+与Fe3+物质的量之比为1:2 |
| D |
将FeCl2溶液加入到NaClO溶液中 Fe2+ +2ClO-+2H2O = Fe(OH)2↓+2HClO |
错误,Fe2+与ClO-会发生氧化还原反应: 2Fe2+ +ClO-+5H2O =2Fe(OH)3↓+ Cl-+4H+ |
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
则下列说法不正确的是
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+===CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
| D.在Mg(HCO3)2溶液中滴加足量澄清石灰水发生反应的离子方程式为Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O |
下列表示对应化学反应的离子方程式正确的是
| A.足量Cl2通入FeBr2溶液中:Br-+ Cl2 = Br2 +2Cl- |
| B.用NaClO除去水体中CO(NH2)2产生CO2和N2:3ClO +CO(NH2)2=3Cl- +CO2↑+N2↑+2H2O |
| C.过量CO2通入Na2SiO3溶液中:Si032-+CO2+H2O = H2SiO3↓+CO32- |
| D.Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2+ +HCO3-+OH-= CaCO3↓+H2O |