下列离子方程式正确的是
| A.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH+Al3++2SO+2Ba2++5OH-=AlO+2BaSO4↓+NH3·H2O+2H2O |
| B.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+ H2O |
C.制备Fe(OH)3胶体: Fe3++3H2O  Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
下列反应的离子方程式正确的是( )
A.NH4HCO3溶液与过量KOH浓溶液共热:   |
B.用双氧水和稀硫酸处理印刷电路板: |
C.用FeS除去工业废水中的 |
D.足量的 通人Ca(ClO)2溶液中:Ca2++2C1O 通人Ca(ClO)2溶液中:Ca2++2C1O +SO2=====CaSO4↓+2C1 +SO2=====CaSO4↓+2C1 |
下列离子方程式书写正确的是
| A.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑ |
| B.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O |
| C.漂白粉溶液中通入少量SO2气体:Ca2+ +2ClO- +SO2 +H2O =CaSO3↓+2HClO |
| D.Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O |
下列反应的离子方程式正确的是( )
| A.铝粉投入到NaOH溶液中:2Al + 2OH- = 2AlO2- + H2↑ |
| B.钠加入到足量的水中:Na+2H2O=Na++2OH-+H2↑ |
| C.AlCl3溶液中加入足量的氨水:Al3+ + 3OH- = Al(OH)3↓ |
| D.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ |
下列离子方程式正确的是
A.NaHS溶液水解的方程式为:HS-+H2O S2-+H3O+ S2-+H3O+ |
| B.向H218O中投入Na2O2固体: 2H218O + 2Na2O2 ===4Na++ 4OH-+ 18O2↑ |
| C.在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2+ + 2Br-+ 2Cl2="==" 2Fe3++Br2+4Cl- |
D.用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ H2↑+Cl2↑ H2↑+Cl2↑ |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是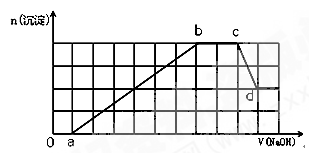
| A.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓ |
| B.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.d点溶液中含有的溶质只有NaAlO2 |
下列离子方程式书写正确的是( )
| A.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B.碳酸钠溶液与硫酸氢钠溶液反应:CO32-+H+=CO2↑+H2O |
| C.Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D.向FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
能正确表示下列反应的离子方程式是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O |
| B.NaHSO3溶液中通入少量Cl2:HSO3- + Cl2+ H2O=3H+ +SO42- +2Cl- |
C.氯化钠与浓硫酸混合加热:H2SO4+2Cl- SO2↑+Cl2↑+H2O SO2↑+Cl2↑+H2O |
| D.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
下列离子方程式正确的是
| A.向明矾溶液中加入氢氧化钡溶液至沉淀的物质的量达到最大值: Al3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ AlO2-+2H2O |
| B.向澄清石灰水中通入少量CO2:OH- + CO2=HCO3- |
| C.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2CH3COOH=Ca2++ 2CH3COO-+H2O + CO2↑ |
| D.硝酸银溶液中加入铜粉:Ag+ + Cu=Cu2+ + Ag |
下列离子方程式正确的是( )
| A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B.将Na块投入水中,产生气体:Na+2H2O=Na++2OH-+H2↑ |
| C.0.1 mol·L-1亚硫酸氢钠溶液的pH约为3:HSO3-+H2O=SO32-+H3O+ |
| D.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
能正确表示下列反应的离子方程式是
A.硫氢化钠的水解反应 HS-+ H2O  S2-+H3O+ S2-+H3O+ |
| B.碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-= CaCO3↓+2H2O+CO32- |
| C.Na2O2与H2O反应制备O2 Na2O2 + H2O = 2Na+ + 2OH-+ O2↑ |
| D.向碳酸钠溶液中加少量盐酸 CO32-+2H+ = H2O+CO2↑ |
现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
已知:①E、F两溶液呈碱性;G、M、N 溶液呈酸性。
②向N溶液中逐滴滴加F溶液至过量,沉淀量先增加后减少但不消失。
③M溶液与另外四种溶液反应都能产生沉淀。
下列说法正确的是( )
A.N溶液与过量的F溶液反应的离子方程式为: Ba2+ + SO42- = BaSO4↓
B.E溶液与N溶液混合发生反应的离子方程式为:2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓+ 3CO2↑
C.M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中
D.将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为
2H+ + CO32- = CO2↑+ H2O
下列离子方程式书写及评价合理的是
| |
离子方程式 |
评价 |
| A |
Mg(HCO3)2溶液中加入足量的NaOH溶液Mg2++2HCO3-+2OH-=MgCO3↓+ CO32-+ 2H2O |
正确,NaOH过量,酸式盐与碱完全反应生成正盐和水; |
| B |
1mol/L的NaAlO2溶液与2.5mol/L的HCl溶液等体积混合2AlO2-+5H+ =Al3+ +Al(OH)3↓+H2O |
正确,AlO2-与H+按物质的量1:1反应转化为Al(OH)3,过量的H+再将一半Al(OH)3转化为Al3+ |
| C |
将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8 H+= Fe2+ + 2Fe3+ + 4H2O |
正确,Fe3O4化学式可改写为FeO·Fe2O3,Fe2+与Fe3+物质的量之比为1:2 |
| D |
将FeCl2溶液加入到NaClO溶液中 Fe2+ +2ClO-+2H2O = Fe(OH)2↓+2HClO |
错误,Fe2+与ClO-会发生氧化还原反应: 2Fe2+ +ClO-+5H2O =2Fe(OH)3↓+ Cl-+4H+ |
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
则下列说法不正确的是
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+===CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
| D.在Mg(HCO3)2溶液中滴加足量澄清石灰水发生反应的离子方程式为Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O |
下列表示对应化学反应的离子方程式正确的是
| A.足量Cl2通入FeBr2溶液中:Br-+ Cl2 = Br2 +2Cl- |
| B.用NaClO除去水体中CO(NH2)2产生CO2和N2:3ClO +CO(NH2)2=3Cl- +CO2↑+N2↑+2H2O |
| C.过量CO2通入Na2SiO3溶液中:Si032-+CO2+H2O = H2SiO3↓+CO32- |
| D.Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2+ +HCO3-+OH-= CaCO3↓+H2O |