甲~庚等元素在元素周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是

| A.丙与戊的原子序数相差28 |
| B.气态氢化物的稳定性:庚<己<戊 |
| C.常温下,甲和乙的单质均能与水剧烈反应 |
| D.丁的最高价氧化物可广泛可于太阳能电池 |
下列有关性质的比较,不能用元素周期律解释的是
| A.酸性:H2SO4>H3PO4 | B.非金属性:Cl>Br |
| C.碱性:NaOH>Mg(OH)2 | D.热稳定性:Na2CO3>NaHCO3 |
一般情况下,前者无法决定后者的是
| A.原子核外电子排布——元素在周期表中的位置 |
| B.弱电解质的相对强弱——电离常数的大小 |
| C.分子间作用力的大小——分子稳定性的高低 |
| D.物质内部储存的能量——化学反应的热效应 |
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大, W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)L的元素符号为 ;M在元素周期表中的位置为 。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 。
(3)Y的最高价氧化物的电子式为 。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是 。
I、有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大。A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍。A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物。回答下列问题:

(1)写出相应元素名称: C_________
(2)化合物甲、乙均是由A、C、D、E四种元素组成的中学常见的化合物,甲既能与盐酸反应,又能与NaOH溶液反应,甲溶液和乙溶液反应的离子方程式为:_____________________;丙由C、D、E三种元素组成(原子个数比为3:2:2),乙溶液和丙溶液反应的离子方程式为:_________________。
(3)N2H4的电子式为 。将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
Ⅱ 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
试回答下列问题
(1)G中含有的化学键类型有: 。
(2)写出②反应的化学方程式 并用双线桥法表示该反应电子转移的方向和数目 。
下列参数比较及解释均正确的是
| 选项 |
参数 |
比较 |
解释 |
| A |
沸点 |
HF<HCl<HI |
组成结构相似的物质,相对分子质量越大沸点越高 |
| B |
半径 |
Na+﹥Al3+﹥S2- |
同一周期粒子半径随原子序数的递增逐渐减小 |
| C |
酸性 |
H2SO3>H2CO3 |
元素的非金属性越强,其含氧酸的酸性越强 |
| D |
还原性 |
P3->S2->Cl- |
元素的非金属性越强,简单阴离子的还原性越弱 |
氮元素在自然界中存在多种价态,结合题干回答下列问题:
23.氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。
24.氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)。
a.NH3比PH3稳定性强
b.氮气与氢气能直接化合,磷与氢气很难直接化合
c.硝酸显强氧化性,磷酸不显强氧化性
d.氮气常温是气体,磷单质是固体
25.已知,氯胺NH2Cl熔点-66℃,NH4Cl熔点340℃,氯胺的电子式为 ,从物质结构的角度解释两者熔点相差较大的原因 。
26.NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为 。
27.工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,反应过程中生成AlO2-、氮气和氨气,若氮气和氨气的体积比为4:1,则还原剂和氧化剂的物质的量之比为 ,若氮气和氨气的体积比为1:1,则除去0.1mol NO3-,消耗铝______g。
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是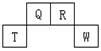
| A.W在周期表中的位置是第三周期ⅤA族 |
| B.原子半径Q>R>T |
| C.W原子得电子能力强于Q原子,且可形成共价化合物QW2 |
| D.原子序数比R多1的元素只能形成一种氢化物 |
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是 ( )

| A.四种元素的简单氢化物都为极性分子 |
| B.最高价氧化物对应的水化物的酸性W比Z弱 |
| C.Z的单质与氢气反应较Y剧烈 |
| D.X、Y形成的化合物都易溶于水 |
下列说法中正确的是( )
| A.中子数为18的氯原子可表示为18Cl |
| B.盐酸和食醋既是化合物又是酸 |
| C.可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去 |
| D.6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同 |
A、B、C、D、E、F、G、H和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:① A、B 、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使石蕊试纸变色;② A和I相遇产生白色烟雾;③ B和E都能使品红溶液褪色;④ 将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;⑤ 将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;⑥ C和D相遇生成红棕色气体;⑦ G在D中燃烧可以产生E和H2O;⑧ 将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A。回答:
(1)A的化学式是 ,②中烟雾的化学式是 ;
(2)④中发生反应的化学方程式是 ;
(3)⑤中发生反应的化学方程式是 ;
(4)C的化学式是 ,D的化学式是 ;
(5)⑦中发生反应的化学方程式是 ;
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| C.元素W和M的某些单质可作为水处理中的消毒剂 |
| D.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
下列说法正确的是
| A.福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| B.分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定高 |
| C.CO2、H2O、N2这些分子中所有原子都满足最外层为8电子的结构 |
| D.原子结构模型的演变经历了 : |

下列有关化学用语表达正确的是
A.H2O2的电子式: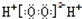 |
| B.二氧化硅的分子式:SiO2 |
C.乙酸分子的球棍模型: |
D.离子结构示意图 ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- |