Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子。
(1)Z原子的价电子排布式为_________________。
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是_______________。
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为___________,从原子结构的角度解释不存在RCl5分子的原因_______。
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为_______________。
②甲→乙的化学方程式为______________。
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为______________。
A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族元素,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。
请回答下列问题:
(1)A元素单质的化学式为______ ,D元素的原子结构示意图为______ 。
(2)由A、B、C三种元素形成的化合物的电子式为______ ,这种化合物形成的晶体 中所含的化学键类型有______ 。
(3)由A、B、D三种元素形成的一种化合物和A、B两种元素形成的一种化合物能发生氧化还原反应,反应的化学方程式:________ 。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是______ (用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分 的挥发),溶液的pH近似为7,则该过程的总反应方程式为______ 。
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图(反应条件省略)
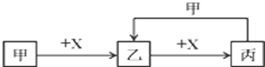
(1)若甲为气态非金属单质,丙能与人体血液中的血红蛋白结合而使人中毒,则乙的电子式为 。
(2)若甲为黄绿色气体,X为常见的金属,则X在元素周期表中的位置是 ,丙的水溶液呈 (填酸性、碱性或中性),原因是: (用离子方程式表示)。含amol乙的溶液溶解了一定量X后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的乙的物质的量是 mol。
(3)若X为酸性氧化物且具有漂白性,甲溶液的焰色反应呈黄色,则标准状况下8.96 L 气体X与2 L 0.25 mol/L的甲溶液反应生成的溶液中乙和丙的物质的量浓度之比为(不考虑离子的水解) 。另有和丙具有相同元素组成的物质丁,丙和丁能反应生成气体,写出该反应的离子方程式 。
(4)若X为强碱溶液,乙为白色胶状沉淀,则甲与丙反应的离子方程式为 。
I、有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大。A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍。A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物。回答下列问题:

(1)写出相应元素名称: C_________
(2)化合物甲、乙均是由A、C、D、E四种元素组成的中学常见的化合物,甲既能与盐酸反应,又能与NaOH溶液反应,甲溶液和乙溶液反应的离子方程式为:_____________________;丙由C、D、E三种元素组成(原子个数比为3:2:2),乙溶液和丙溶液反应的离子方程式为:_________________。
(3)N2H4的电子式为 。将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
Ⅱ 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
试回答下列问题
(1)G中含有的化学键类型有: 。
(2)写出②反应的化学方程式 并用双线桥法表示该反应电子转移的方向和数目 。