有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题:
(1)①A与E形成的化合物的化学式是 。
②B的最高价氧化物化学式为 。
③C的元素名称为 。
(2)D的单质与水反应的方程式为: 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,有关反应的离子方程式为: , 。
下表是周期表中的一部分,根据A-I在周期表中的位置,按题目要求回答。
| 族 周期 |
I A |
Ⅱ A |
Ⅲ A |
Ⅳ A |
Ⅴ A |
Ⅵ A |
Ⅶ A |
O族 |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
D |
E |
|
G |
I |
| 3 |
B |
|
C |
|
F |
|
H |
|
(1)表中元素,化学性质最不活泼的是 ,氧化性最强的单质是 (以上填化学式)
(2)最高价氧化物的水化物酸性最强的是 (填化学式)。
(3)A分别与D、E形成的化合物中,最稳定的 (填化学式)。
(4)在B、C、E、F、G、H中,原子半径最大的是 (填元素符号)
(5)A和D组成化合物的电子式 ,A、E、H三元素组成的化合物EA4H中所含的化学键为______________________。
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式 _____________。
下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑥ |
|
⑦ |
|
|
| 3 |
① |
③ |
⑤ |
|
|
|
⑧ |
⑩ |
| 4 |
② |
④ |
|
|
|
|
⑨ |
|
(1)10种元素中,化学性质最不活泼的是 ,除⑩外原子半径最大的是 。
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是 。
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为 。
(4)元素⑦的氢化物的化学式为 ;该氢化物和元素②单质反应的化学方程式为 。
(5)①⑨形成的化合物灼烧时火焰焰色为 ;该化合物的溶液与元素⑧的单质反应的化学方程式为 。
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式____________________。
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为 ___;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为 _____;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为_____________________。
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E 和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________。
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有______。检验该化合物中的阳离子的方法是________(用离子方程式表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:________________________。若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________。
钛、铜可以作为多种催化剂的主体。如以TiO2覆盖在Cu2Al2O4表面作催化剂,可以将CO2与CH4直接转化成乙酸。
请回答下列问题:
(1)钛有 和
和 两种原子,它们互称为 ,Ti的基态原子电子排布式为 。
两种原子,它们互称为 ,Ti的基态原子电子排布式为 。
(2)Cu在元素周期表中的位置是 。乙酸分子中碳原子的杂化形式有 。
(3)由Ca、Ti、O三种元素组成某矿物晶体,其晶胞结构如图所示。则该矿物的化学式为 。
(4)用TiCl4与热水反应可制备TiO2,反应的化学方程式是 。
(5)用稀硝酸溶解Cu2Al2O4的离子方程式是 。
(6)用H2O2和H2SO4的混合溶液可溶出印刷电路板上的Cu。
已知:ⅰ、CuSO4(aq)+ H2(g)="=" Cu(s)+H2SO4(aq) ΔH=-64.4kJ/mol
ⅱ、2H2O2(l)="=" 2H2O(l)+ O2(g) ΔH= -196.4 kJ/mol
ⅲ、H2(g)+ O2(g)="=" H2O(l) ΔH= -285.8 kJ/mol
O2(g)="=" H2O(l) ΔH= -285.8 kJ/mol
写出Cu与H2SO4、H2O2反应生成CuSO4(aq)和H2O(l)的热化学方程式: 。
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式 。
(2) 化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)用电子式表示化合物D2C的形成过程 。
(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;负极反应:________________________;
(10分)如图是依据各种元素(原子)的性质与原子序数(1~20)的关系而作出的,各图的纵轴可能代表下列某一性质:核电荷数、中子数、最高正化合价、原子半径、得电子能力,A、B、C分别代表三种元素。(注意:图3中原子序数为8、9的元素和图4中原子序数为2、10、18的元素在纵轴上没有对应的数值)
请回答下列问题:
(1)图2纵轴代表的性质是 ,图4纵轴代表的性质是 。
(2)A元素的其最低负化合价为 。
(3)B、C两种元素形成的化合物中,C显最高正化合价而B显最低负化合价,该化合物的化学式为 。
(4)1~20号元素中,原子半径最大的是(稀有气体除外) 。
附加题:(共10分)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,则 PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=" a" kJ·mol-1
②PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=" b" kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H=" c" kJ·mol-1
反应3PbS(s)+ 6O2(g)=3PbSO4(s) ΔH= kJ ·mol-1(用含a,b ,c的代数式表示)。
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为 。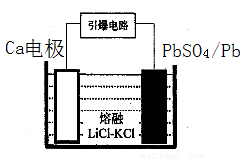
(5)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(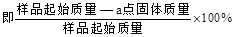 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x= _和m:n=_ _。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x= _和m:n=_ _。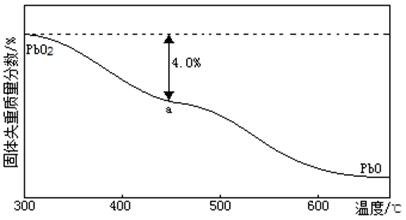
元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据为 (填字母)。
| A.Cl2、Br2、I2的熔点 | B.Cl2、Br2、I2的氧化性 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
(3)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
①D为 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
(4)某化合物是一种不稳定的物质,其分子组成可用OxFy表示,10mLOxFy气体能分解生成15mLO2和10mLF2(同温同压)。
①该化合物的化学式为 。
②已知该化合物分子中x个氧原子呈…O—O—O…链状排列,则其电子式为 ,…O—O—O…链状排列中中间氧的价态为 。
下表列出了①~⑨九种元素在周期表中的位置。请回答(用化学用语):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑤ |
|
⑥ |
|
|
| 3 |
① |
③ |
④ |
|
|
|
⑦ |
⑨ |
| 4 |
② |
|
|
|
|
|
⑧ |
|
(1)在这些元素中,最活泼的金属元素是 ;最活泼非金属元素是 ;最不活泼的元素是 。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式 ;能形成两性氢氧化物的元素是 。
(3)①、②、③三种元素的原子半径由大到小的顺序依次为 。
(4)⑥元素的氢化物是 ,该氢化物在常温下与②发生反应的化学方程式为 ,所得溶液的PH 7.
(5)用电子式表示 ①和⑧元素形成化合物的过程 。
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示。
请回答下列问题:
(1)X代表的元素符号____________,在周期表中所处的位置是第______周期______族,固态X2属于________(填“原子”、“离子”或“分子”)晶体。
(2)W和Y形成的化合物中,W呈现最高化合价的化合物的化学式是__________________;
(3)Z和Y形成的化合物Z2Y3是______性化合物,它与NaOH溶液反应的方程式为________。
(4)Q的氢化物的电子式___________________,把它溶于水,由于_______________受到破坏而电离出H+和Q-,使溶液呈__________性.结构类型相同Y、W的氢化物的沸点从高到低排列次序是(填化学式)____________。
(5)上述元素的最高价氧化物对应的水化物酸性最强的是________(写化学式)。
(6)Y、Q的单质或两元素之间形成的化合物可作水消毒剂的有____________,________(写出其中两种物质的化学式)。
有四种短周期元素,它们的结构、性质等信息如下表所述:
| 元素 |
结构、性质等信息 |
| X |
构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y |
短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z |
与Y同周期,其最高价氧化物的水化物呈两性 |
| M |
海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置是______________,其相对分子质量最小的气态氢化物的化学式是______________。
(2)Y离子半径比Z离子的半径______(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:_____________________。
(3)X与M两元素的气态氢化物的稳定性更强的是______________(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)______________。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为__________________________。
(2)②、③、⑦的最高价氧化物对应水化物的酸性由强到弱的顺序是___________________。
(3)写出⑥的最高价氧化物对应水化物分别与⑤、⑧的最高价氧化物对应水化物反应的离子方程式: , 。
(4)由表中①、④两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)______________。
| A.MnO2 | B.NaCl | C.Na2SO3 | D.KMnO4 |
有A、B、C、D、E四种短周期元素,原子序数依次增大,在周期表中B与C相邻、D与E相邻。已知A原子的电子层数与它的核外电子总数相同。B元素的氢化物与E元素的氢化物反应只生成一种盐;C、D位于同一族,它们能组成DC2、DC3两种常见化合物。请回答下列问题:
(1)C是________,D是____________,E是____________(填元素名称)。
(2)由A、B、C中的两种元素组成,且与A2C分子具有相同电子数的两种阳离子是________和________(写化学式)。
(3)D与E可形成共价化合物D2E2,分子中D与E均满足8电子稳定结构,则D2E2的电子式为_______。
(4)A、B、C可以形成一种盐,此盐中A、B、C元素的原子的个数比为4:2:3,该盐的化学式是____________。该盐受热可产生B的单质和B的最高价氧化物的水化物,对应化学方程式是____________。
(5)A、B可以形成一种离子化合物,电子式是____________
A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
| 元素符号 |
元素性质或原子结构 |
| A |
A是形成化合物最多的元素 |
| B |
B元素的单质在空气中含量最多 |
| C |
C元素在地壳中含量最多 |
| D |
D元素在同周期中金属性最强 |
| E |
常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置 ;
(2)B的最简单气态氢化物分子空间构型 ;其沸点高于同主族的其它气态氢化物原因 ;
(3)D的最高价氧化物对应水化物的化学键类型 ;
(4)B、C、D、E简单离子半径大小 (用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式 ,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式 .