下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)表中某元素最高正价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是______,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是_______(用离子符号表示,下同)。②、④、⑤元素的氢化物的沸点由高到低的顺序是____________。
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是________________。
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:
① X、Y与水混合后反应的离子方程式为________________。
② N→⑦的单质反应的化学方程式为_________________。
③ 元素④形成的单质的电子式为________________。
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为__________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________。
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式_________________________
(12分)X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X的氢化物的电子式为___________
(2)元素Y的一种中子数为8的同位素可测定文物年代,这种同位素的符号是______________。
(3)元素Z能与氢元素形成+1价阳离子,该阳离子粒子符号是_________________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为_____________________。
(5)ZW3常温下呈液态,可与水反应生成一种弱酸和一种弱碱,反应的化学方程式为__ ________。
(6)探寻物质的性质差异性是学习的重要方法之一,X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是_____________(用酸的化学式表示)。
元素周期表的用途广泛。
(1)用“>”或“<”填空:
| 离子半径 |
非金属性 |
酸性 |
沸点 |
| K+_____S2- |
N____O |
硫酸_____高氯酸 |
HF____HCl |
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)
元素周期表的用途广泛。
(1)用“>”或“<”填空:
| 离子半径 |
非金属性 |
酸性 |
沸点 |
| K+_____S2- |
N____O |
硫酸_____高氯酸 |
HF____HCl |
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)
W、X、Y、Z四种短周期元素在周期表中的位置如图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。

请回答下列问题。
(1)H2Y2的电子式为______________________,Z在周期表中的位置___________________。
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________。
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_____________。
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的___________极,其电极反应式为____________________。
A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素。F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的电子排布式
(2)B和C比较,第一电离能较大的元素是 (填元素符号),其原因为
(3)A与B形成的化合物易溶于化合物甲,其主要原因是
(4)甲、乙两分子中含有非极性共价键的是 (填分子式),它中心原子的杂化方式是
(5)已知化合物丁熔点190℃,沸点183℃,结构如右图所示。
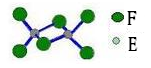
①丙和丁比较,熔点较低的化合物是 (填化学式),其原因为
②则丁含有的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键
D.配位键 E.范德华力
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
根据信息回答下列问题。
(1)周期表中基态Ga原子的价电子排布式为____________________。
(2)Fe元素位于周期表的____________区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为_____________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______________和____________(填化学式)。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有_______________________。
(4)根据VSEPR理论预测 离子的空间构型为_________________。B、C、D、E任意两原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为________________(写2种)。
离子的空间构型为_________________。B、C、D、E任意两原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为________________(写2种)。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________________;A、B、C的电负性由大到小的顺序为___________;(均用“<”或“>”连接)
(2)B的氢化物的分子空间构型是_____________。其中心原子采取_____________杂化。
(3)写出化合物AC2的电子式____________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为____________。
(4)E的价层电子排布式是____________,在形成化合物时它的最高化合价为_____________,ECl3形成的配合物的化学式为________________。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是________________。
(Ⅰ)四种短周期元素A、B、C、D的性质或结构信息如下:
①原子半径:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:
甲: 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二
乙: 无色,无气味并且易燃.是常见的一种基础能源
无色,无气味并且易燃.是常见的一种基础能源
丙: 有强氧化性的弱酸,可以用于消毒杀菌
有强氧化性的弱酸,可以用于消毒杀菌
请根据上述信息回答下列问题.
(1)B元素在周期表中的位置第二周期_______________,请写出BC2分子的结构式_____________。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂.E单质与甲反应有化合物X生成.请写出以下两个反应的离子方程式:
①A元素的单质与物质甲发生的离子反应方程式_____________________。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的离子反应方程式为_________________________。
(Ⅱ)某研究小组将CaCl2和H2在一定条件下反应,制得两种化合物(甲和乙).元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性.请回答下列问题:
(1)甲的电子式是_________________。
(2)甲与乙溶液反应可得H2,其化学方程式是_____________________。
【物质结构与性质】2014 年10 月7 日,赤崎勇、天野浩和中村修二因发明“高亮度蓝色发光二极管(LED)”获得2014 年诺贝尔物理学奖。制作LED 首先在衬底上制作氮化镓(GaN)基的外延片,常用的衬底主要有蓝宝石(Al2O3)、碳化硅和硅,还有砷化镓(GaAs)、AlN、ZnO 等材料。回答下列问题:
(1)氮和砷(As)位于同一主族,二者中电负性较大的是 (填元素符号,下同),第一电离能较大的是 。
(2)基态Zn 原子的价电子排布式为 ,价层电子占有的原子轨道数为 。
(3)Al2O3的熔点很高,Al2O3属于 晶体。Al2O3的熔点比NaCl 高,其原因是 。
(4)碳化硅的晶胞结构如图所示,其中白球代表的是 原子,一个晶胞中含有该原子的个数为 。

填空题(共9分)下表中列出了五种短周期元素A、B、C、D、E的信息,请推断后作答:
| 元素 |
有关信息 |
| A |
元素主要化合价为-2,原子半径为0.074nm |
| B |
所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
| C |
原子半径为0.102nm,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D |
最高价氧化物对应水化物,能按1:1电离出电子数相等(10个电子)的阴阳离子 |
| E |
原子半径为0.075nm,最高价氧化物对应水化物与其氢化物组成一种盐X |
写出A、E两种元素符号 、 。
画出B原子的核外电子排布式: ;写出D元素最高价氧化物对应水化物的电子式: 。
29.盐X水溶液显 (选填“酸”、“碱”或“中”)性,用离子方程式解释其原因: 。
30.D2CA3的溶液与B的单质能发生氧化还原反应,其反应的离子方程式为 。
31.已知E元素的某种氢化物Y与A2的摩尔质量相同,Y在常温下为液态,Y的化学式为 ,Y所含的化学键为 。
(a)极性键 (b)非极性键 (c)离子键
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。

已知:A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。请回答下列问题:
(1)构成C物质的元素在周期表中的位置是 ,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)D的水溶液呈 性,请用离子方程式解释原因:
(3)上述反应中属于置换反应的是 (填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式:
(5)气体C通入KI溶液中,氧化产物为KIO3,则氧化剂与还原剂物质的量之比为
元素X、Y、Z、W、M、N原子序数依次增大。X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期。它们四者原子序数之和为22,最外层电子数之和为16。在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构。请回答下列问题:
(1)M元素在周期表中的位置是 ,X、Y、Z、W、M的原子半径由大到小的顺序为 (用元素符号表示)。
(2)写出Y2X2的电子式 ;Z2X4结构式 。
(3)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味,且能使品红溶液褪色的气体放出,该反应的离子方程式为 。
(4)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式 。
(5)写出足量NW2通入硝酸钡溶液中的离子方程式 。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

(1)上述元素的单质可能是电的良导体的是_______(填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
| |
锂 |
X |
Y |
| 第一电离能 |
519 |
502 |
580 |
| 第二电离能 |
7296 |
4570 |
1820 |
| 第三电离能 |
11799 |
6920 |
2750 |
| 第四电离能 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量: 。
②表中的Y可能为以上13种元素中的 (填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式 。
(3)根据构造原理,用电子排布式表示e的核外电子排布式 。
(4)以上13种元素中, (填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______(用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________。