Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大。Q元素的阳离子核外无电子,W元素原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的价电子排布式为3d104s1。
(1)W位于元素周期表第_______周期第________族,W的第一电离能________(填“大于”或“小于”)X的第一电离能。
(2)XQ3分子的空间构型为_______,所含化学键类型为________共价键(填“极性”或“非极性”)。
(3)Z基态原子核外电子排布式是______________,Z的单质与过量的X 的最高价氧化物对应的水化物的稀溶液反应的离子方程式为______________。
(4)已知:
①WQ4(g)+4XY2(g)=4XY(g)+WY2(g)+2Q2Y(g) ΔH=-574 kJ/mol
②WQ4(g)+4XY(g)=2X2(g)+WY2(g)+2Q2Y(g) ΔH=-1160 kJ/mol
此温度下若用4.48 L(已折算成标准状况下)WQ4还原XY2至X2。整个过程中放出的热量为___kJ。
元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的化学式_____。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子电子转化成10电子分子的化学方程式____(分解反应)。
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________。
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为____,B的化学式为_______。
A、B、C、D、E、F代表6种元素。请填写下列空白。
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与Ar相同,B的元素符号为 ,C的元素符号为 。
(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
(5)F元素的基态原子的外围电子排布式为3d54s2,其原子结构示意图为 ,其最高正价为 ;位于元素周期表中第 周期 族。
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| |
W |
X |
Y |
Z |
| 结构 或性质 |
最高价氧化物对应的水 化物与其气态氢化物反 应得到离子化合物 |
焰色反应呈黄色 |
在同周期主族元素形成的简单离子中,离子半径最小 |
最高正价与最 低负价之和为6 |
(1)W元素和氢可形成离子化合物,其电子式为 。
(2)Y元素和Z元素可形成YZ3化合物,可用于净水剂,净水原理 (用离子方程式表示)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
a.最高价氧化物的水化物能反应 b.相应硫酸盐水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②由X、Y、氢、氧四种元素所组成的化合物,能与盐酸以1:4反应生成两种常见盐和水,则该化合物的化学式为 。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,混合后溶液中离子浓度由大到小的顺序是 。
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置___________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为_______ _;
该化合物和单质F反应的离子方程式为_______________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为_____ ___。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为____________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为 __。
下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)____________ ____。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______。
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式: 。
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。
回答下列问题:
(1)元素c为________;d为_______。
(2)由这些元素形成的双原子分子为__________________。
(3)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是_______,离子晶体的是_______,金属晶体的是_______,分子晶体的是_______(每空填一种)。
(4)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,两种化合物的电子式分别为: 、 ,该反应的化学方程式为:______ _。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;元素B的氢化物能用于刻蚀玻璃; C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是___________,A、B、C、D的第一电离能由小到大的顺序为__________。
(2)化合物CA的熔点远高于C的氯化物的熔点,理由是______________;
(3)A的最高价含氧酸根离子中,其中心原子采取_____杂化,D的低价氧化物分子的空间构型是_______。
(4)B2与NaOH溶液反应的产物之一是OB2,该反应的离子方程式为__________。
(14分)短周期元素W、X、Y、Z,其有关性质或结构信息如表所示。
| 元素 |
W |
X |
Y |
Z |
| 有关性质或结构信息 |
能形成+7价的化合物 |
基态原子核外s能级上的电子数是P能级上电子数的2倍 |
该元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 |
通常情况下能形成同周期中最稳定的双原子分子 |
(1)X位于元素周期表中第________周期第_______族,元素X和元素Y相比,电负性较小的是_______ (写元索名称)。化合物XY2晶体与X的单质晶体属_______ (填同一类型或不同类型)。
(2)写出元素Y的含有10个中子的一种核素符号_______,X的一种氢化物X2H2分子中 键与
键与 键的数目之比为_______。
键的数目之比为_______。
(3)Y与Z可以组成多种形式的化合物.其中Z2Y5能与水反应生成物质A。写出物质A的稀溶液与过量的Fe反应的离子方程式:____________________________。
(4)W的最髙价氧化物为无色液体,9.15g该物质与足量的水混合,得到一种稀溶液,并放出QKJ热量,该反应的热化学反应方程式为______________。
A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为 。
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式___________,写出②中离子反应方程式__________。
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为 mol。
(4)化合物D和E相互转化D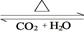 E,若有D和E·
E,若有D和E·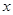 H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E·xH2O的化学式为 。
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E·xH2O的化学式为 。
(13分)下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题
(1)表中某元素最高正价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是______,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是_______(用离子符号表示,下同)。②、④、⑤元素的氢化物的沸点由高到低的顺序是____________。
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是________________。
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:
①X、Y与水混合后反应的离子方程式为________________。
②N→⑦的单质反应的化学方程式为_________________。
③若将Y溶液加热蒸干、灼烧后得到的物质的化学式是________________。
I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。

(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____________。
(5)B与D所形成的化合物的化学键类型为______________。
(6)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_____________。
(7)实验室里除去BA2气体,可用下列试剂中的_____________(填字母)。
A.酸性高锰酸钾溶液 B.浓硫酸
C.NaOH溶液 D.NaHCO3溶液
(11分) 已知A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如下表所示。
| 元素 |
原子结构特征或有关物质的性质 |
| A |
原子的最外层电子数是其内层电子数的2倍 |
| B |
其单质是空气中含量最多的物质 |
| C |
原子的最外层电子数是其电子层数的4倍 |
| D |
位于第ⅡA族,其原子半径比E的大 |
| E |
是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
| F |
原子序数16,其单质在通常状况下为固体 |
| G |
原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是_________。这七种元素中,不属于主族元素的元素的名称是 。
(2)在E、F、G三种元素中,原子半径最小的是 (填元素符号)。
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为 ,分子的空间结构为 。A与氧元素可形成化合物AO2,该化合物分子的电子式为 。
(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈 (填“酸”、“碱”或“中”)性,原因为________(用方程式表示)
下面的表格是元素周期表的一部分,其中的序号对应的是元素。
| ① |
|
|
|||||||||||||||
| |
② |
|
|
③ |
|
|
|
④ |
|||||||||
| |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
|
||||||||||
| |
|
|
|
|
⑨ |
|
|
|
|
|
|
|
|
|
|
|
|
请回答下列问题:
(1)元素⑨的价电子排布式为___________。
(2)表中某元素最外电子层上p电子数比s电子数少1,该元素的元素符号为___。
(3)②、④、⑤、⑥四种元素的第一电离能由大到小的顺序是(填序号) _________。
(4)某元素的价电子排布式为nsnnpn+1,该元素与元素①形成的气态化合物分子的空间构型为_______。
(5)按原子轨道的重叠方式看,元素①③形成的相对分子质量最小的分子中,含_________键;元素⑤和⑧形成的化合物晶体类型为_________。
A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
| 元素 |
元素性质或结构 |
| A |
最外层电子数是其内层电子数的2倍 |
| B |
B元素的单质在空气中含量最多 |
| C |
C元素在地壳中含量最多 |
| D |
D元素在同周期中金属性最强 |
| E |
常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置 。
(2)B最简单气态氢化物的电子式 ,属于 化合物(填“离子”或“共价”);D的最高价氧化物的水化物电子式 ,所含化学键类型: 。
(3)B、C、D、E简单离子半径由大到小顺序为: ﹥ ﹥ ﹥ (填元素符号)。
(4)用电子式表示E的氢化物的形成过程 。
(5)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式: 。
(6)19.2g金属铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下NO、NO2(不考虑N2O4的存在)混合气6.72L,则参加反应的HNO3的物质的量为 。