假定元素周期表是有限的,请根据已知的元素周期表的某些事实和理论填写出可归纳出的一些假说。
(1)根据每个周期最后一种金属元素出现的族序数,预测周期表中原子序数最大的金属元素将在_____周期,_____族(注:把零族看成ⅧA)。周期表示在填满_____周期后将结束)。
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看作非金属),预测周期表中应该有_____种非金属元素,还有_____种未发现。未发现的非金属处在_____周期_____族。
有A、B、C三种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒均与氖原子有相同的电子层结构。C元素的原子只有1个电子。试写出:
(1)A、B的元素符号或名称:
A B
(2)画出B元素的离子结构示意图
(3)写由该三种元素组成的物质D在水溶液中电离方程式
(4)写出与氖原子有相同数目的电子的多核微粒(一种)
有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的。已知:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由A、B组成,分子中原子个数比为A∶B=1∶1,常温时为气态。
(c)X由A、C组成,分子中原子个数比为A∶B=2∶1,常温时为液态。
(d)Y是由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C∶D=1∶1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子个数比为1∶2。试完成下列各小题:
(1)各元素符号:A_____,B_____,C_____,D_____,E_____。
(2)W的化学式:__________。
(3)X的结构式:__________。
(4)Y的电子式:__________。
(5)Z的化学式:__________。
(6)写出下列反应化学方程式:Y与水反应__________。
根据元素周期律和周期表回答下列问题:
⑴短周期中,金属性最强的元素是 ,非金属性最强的元素是 ;非金属元素共 种(稀有气体除外)(用化学用语回答,下同)。
⑵第3周期中,原子半径最小的元素(稀有气体元素除外)是 ,简单的离子半径最小的是 ,非金属性最强的元素是 ;
(3)周期表中位于第8纵列的铁元素属于第 周期第 族。周期表中最活泼的非金属元素位于第 纵行。
A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。如果A和B同在ⅠA族,当B在A的上周期时,B的原子序数为_____;当B在A的下一周期时,B的原子序数为_____;如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为_____;当B在A的下一周期时,B的原子序数为_____。若A的氯化物化学式为ACly,分子中各原子最外层电子数之和为26,则y的值为_____。
A、B、C、D、E五种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的不同周期邻族元素;D和E的原子序数之和为30。它们两两形成的化合物为甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:(用元素符号作答)
| |
甲 |
乙 |
丙 |
丁 |
| 化合物中各元素原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
(1)写出A~E的元素符号
A: B: C: D: E:
(2)向甲的水溶液中加入MnO2,氧化产物是 。
(3)已知有机物乙的分子为平面结构,碳氢键键角为120°,实验室制取乙的化学方程式为:
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气 体和难溶物,有关离子方程式是:
体和难溶物,有关离子方程式是:
利用周期表中同族元素的相似性,可预测元素的性质。
(1)P元素的基态原子有_______个未成对电子,白磷的分子式为P4,其结构如下图所示。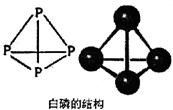
科学家目前合成了N4分子,N原子的杂化轨道类型是________,N -N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途为________。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3)立方氮化硼晶体的结构如下图所示:
该晶体中,B原子填充在N原子的________空隙,且占据此类空隙的比例为________ (填百分数)。
(4) N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是________;立方砷化镓晶体的晶胞边长为a pm,则其密度为________g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
填空题
(1)碳原子最外电子层含有__________个电子,一个碳原子可以跟其他非金属原子形成__________共价键。
(2)在有机合成过程中,引入碳碳双键的三种方法是_____________、________________、_____________。
(3)根据官能团不同,单糖可分为_______________和________________________。
(4)核酸分为DNA和RNA,DNA的主要功能是________________;RNA的主要功能是____________。
周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;X基态原子s能级的总电子数比p能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。
回答下列问题:
(1)R、X、Y中第一电离能最大的是 (填元素符号),其中Y原子的电子排布式为 。
(2)Q、R元素形成的某分子中共有14个电子,该分子中R原子采取 杂化,该分子的立体构型为 。
(3)RY可以和很多过渡金属形成配合物,如Fe( RY)5、Ni(RY)4。其中Fe(RY)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe (RY)5晶体属于 (填晶体类型)。RY与N2互为等电子体,与RY互为等电子体的离子有 (任写一种)。
(4)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气体,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为 。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
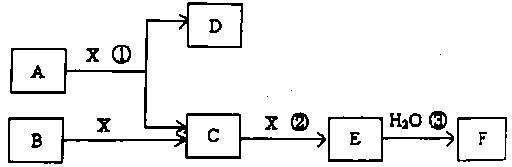
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,,N2+核外3d有9个电子,请回答下列问题:
(1)N位于元素周期表的 区,X、Y、Z的电负性最大的为 。
(2)XZ 中中心原子杂化方式为 。
中中心原子杂化方式为 。
(3) Z的氢化物(H2Z)在乙醇中的溶解度大于H2M,其原因是 。
(4)Na2M2Z3还原性较强,在溶液中易被Cl2氧化成MZ ,常用作脱氯剂,该反应的离子方程式为 。
,常用作脱氯剂,该反应的离子方程式为 。
(5)N与Y可形成的一种具有良好的电学和光学性能的化合物,其晶胞结构如图所示,则该化合物的化学式为 。
( 7分 )同一周期的主族元素,从左到右,原子半径逐渐 ,得电子能力逐渐______,非金属性逐渐______;同一主族元素,从上到下原子半径逐渐 ,失电子能力逐渐______,单质的还原性逐渐______,氧化性逐渐______。
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的价电子数 。
②第三周期元素的最高化合价 。
③F-、Na+、Mg2+、Al3+的离子半径 。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为 。
②X、Y、Z元素符号分别为:X 、Y 、Z 。
③工业上制取单质M的化学方程式为_____________________________ 。
A、B、C、D、E是除稀有气体以外的5种短周期元素,原子序数依次增大并分占三个周期。B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3:4,E原子的电子层数等于最外层电子数。请回答相关问题:
(1)B元素在周期表中的位置 ,C元素是 (填元素符号)
(2)比较D和E简单离子半径大小(用离子符号表示): 。
(3)A与D形成含18电子化合物的化学式为 。
(4)元素E形成的简单离子的水溶液与c的氢化物的水溶液反应的离子方 程式
程式
 ;
;
(5)2007年7月2日,美、德两国科学家成功 合成了具有独特化学特性的E2A6化合物,该物质在D2中能烧,写出它在D2中完全燃烧的化学方程式 .
合成了具有独特化学特性的E2A6化合物,该物质在D2中能烧,写出它在D2中完全燃烧的化学方程式 .