硅酸铜钡是当今用最新科学技术才能合成的一种物质,然而现在发现我国秦朝兵马俑用的一种颜料竟是硅酸铜钡。下列关于硅酸铜钡的说法不正确的是
| A.难溶于水 | B.易溶于水 | C.属于硅酸盐 | D.属于复盐 |
工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,则从经济效益考虑最合理的反应是( )
A.C3H8 3C+4H2 3C+4H2 |
B.C3H8 C3H6+4H2 C3H6+4H2 |
C.C3H8+6H2O 3CO2+10H2 3CO2+10H2 |
D.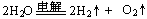 |
“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。它的有效成分是
| A.NaOH | B.NaClO | C.KMnO4 | D.Na2O2 |
某复合材料是以人工碳纤维为增强体、金属钛为基体复合而成的。估计这种材料具有的性质或用途是( )。
①耐高温;②不耐热;③导电、导热;④不导电、不导热;⑤可用于飞机机翼;⑥可用于导弹的壳体
| A.①③⑤⑥ | B.②③⑤⑥ |
| C.②③④ | D.③④⑤ |
人们在日常生活中大量使用各种高分子材料,下列说法正确的是
| A.天然橡胶易溶于水 | B.羊毛是合成高分子材料 |
| C.聚乙烯塑料是天然高分子材料 | D.聚氯乙烯塑料会造成“白色污染” |
下列叙述错误的是
| A.合金材料中可能含有非金属元素 |
| B.人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
| C.加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放 |
下列关于金属的冶炼方法叙述不正确的是
| |
金属 |
存在形式 |
冶炼方法 |
| A |
金 |
游离态 |
金子比沙子密度大,利用水洗法直接分离 |
| B |
银 |
化合态 |
银的金属性弱,用加热 的方法冶炼 的方法冶炼 |
| C |
铁 |
化合态 |
铝的金属性比铁强,可用铝热法炼铁 |
| D |
钠 |
化合态 |
钠的金属性强,一般还原剂很难将其还原出来,所以用电解饱和 溶液方法冶炼 溶液方法冶炼 |
与实际化工生产流程相符的叙述是( )
| A.制备硝酸的工业中,理论上氨中的氮元素100%转化为了硝酸 |
| B.制备硫酸的工业尾气用氢氧化钠溶液吸收 |
| C.让Cl2在H2中燃烧制氯化氢,将氯化氢气体通入水中获得盐酸 |
| D.工业上用电解熔融氧化铝和冰晶石的混合物的方法得到铝 |
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
| A.使用合适的催化剂可以加大反应速率 |
| B.增大N2浓度可以使H2转化率达到100% |
| C.升高温度可以增大反应速率 |
| D.增大N2浓度可以增大反应速率 |
2014年,长沙市首条城市地铁正式营运,在其工程建设中用量最大的硅酸盐材料是
| A.钢筋 | B.水泥 | C.玻璃 | D.陶瓷 |
合成材料的应用与发展,大大方便了人类的生活,但由于合成材料废弃物的急剧增加带来了环境问题,废弃塑料带来的“白色污染”尤为严重。请你就怎样解决“白色污染”提出至少三条切实可行的措施。
(1)_________________________________;
(2)_________________________________;
(3)_________________________________;
(4)_________________________________。
15分)普通纸张的成分是纤维素,在早期的纸张生产中,常采用纸表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______。为防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______。
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是______。
②喷洒Zn(C2H5)2。Zn(C2H5)2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾,钛白粉的一种工业制法是以钛铁矿主要成分(FeTiO3)为原料按下过程进行的,请完成下列化学方程式
下列物质与其用途完全符合的有( )
①Na2CO3—制玻璃; ②SiO2—太阳能电池; ③Na2SiO3—木材防火剂; ④NH3—制冷剂;
⑤Al2O3—焊接钢轨; ⑥NaClO—消毒剂、漂白织物 ⑦Fe2O3—红色油漆或涂料
| A.4个 | B.5个 | C.6个 | D.7个 |
我国及美国、日本等国家都已研制出一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是( )。
| A.氧化铝陶瓷 | B.氮化硅陶瓷 |
| C.光导纤维 | D.玻璃钢 |
【化学——选修2:化学与技术】碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: 
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓) Li2SO4+Al2O3·H2O↓
Li2SO4+Al2O3·H2O↓
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。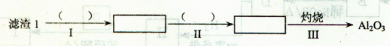
则步骤I中反应的离子方程式是 ,步骤Ⅱ应通入一种气体试剂为 ,步骤II反应完之后需要的操作是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液l中加入石灰乳的作用是(用离子方程式表示) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。