向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是( )(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)

研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)写出镁在CO2中燃烧的化学方程式为________________________。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是__________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为___________________。
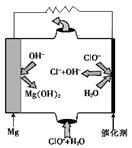

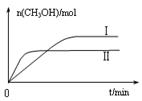
图1 图2 图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=______________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH_______(填“>” “<”或“=”)0。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ ________KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 |
甲 |
乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________。
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
| 实验编号 |
c(HA)/ mol·L-1 |
c(NaOH)/ mol·L-1 |
反应后溶液pH |
| 甲 |
0.1 |
0.1 |
pH=9 |
| 乙 |
c1 |
0.2 |
pH=7 |
下列判断不正确的是( )
A.c1一定大于0.2 mol·L-1
B.HA的电离方程式是HA H++A-
H++A-
C.甲反应后溶液中:c(Na+) >c(OH-) >c(A-) >c(H+)
D.乙反应后溶液中:c(Na+) <c(HA)+c(A-)
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。
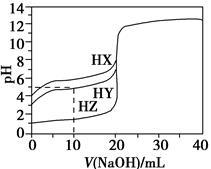
(1)在相同温度下,同浓度的三种酸溶液的导电能力顺序是____________________。
(2)V(NaOH溶液)=20.00 mL时,[HY]________[Y-],当溶液pH=7时,HZ酸和HX酸所需NaOH溶液的体积关系是:HX酸________HZ酸。
(3)将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,溶液中各离子浓度的大小关系为________。
(4)根据滴定曲线,可得Ka(HY)≈________。
已知常温时CH3COOH的电离平衡常数为K。该温度下向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )

| A.a点表示的溶液中[CH3COO-]略小于10-3 mol·L-1 |
| B.b点表示的溶液中[CH3COO-]>[Na+] |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中 均等于K 均等于K |
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的_________(填“正”或“负”)极相连,氢气从____(选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为____________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是________,转移的电子数为________。
芒硝化学式Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
(1)该电解槽的阳极反应式为_______________。此时通过阴离子交换膜的离子数_______________(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的氢氧化钠溶液从出口_______________(填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________。
(4)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为_______________。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有_______________kJ的能量转化为电能。
膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
(1)A装置是__________,B装置是_____________(填“原电池”或“电解池”)。
(2)N2O5在电解池的__________(填“c极”或“d极”)区生成,其电极反应式为_________________。
(3)A装置中通入O2一极的电极反应式为_________________。
(4)若A装置中通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为____________mL·min-1。
反应aA(g)+bB(g) cC(g) (ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g) (ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
回答问题:
(1)反应的化学方程式中a∶b∶c为_________________;
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小的排列次序为__________________;
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是________,其值是_______;
(4)由第一次平衡到第二次平衡,平衡移动的方向是______,采取的措施是____________;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”、“<”或“=”),判断的理由是___________;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min 后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)  CH3OH(g)+H2O(g) △H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )
CH3OH(g)+H2O(g) △H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )

| A.P3>P2 T3>T2 |
| B.P2>P4 T4>T2 |
| C.P1>P3 T3>T1 |
| D.P1>P4 T2>T3 |
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为a克,则a值为( )

| A.14.4 | B.10.4 | C.12.4 | D.14.0 |
根据下列有机物转化流程回答:
(1)写出A的结构简式:____________。
(2)属于取代反应的有(填序号):。属于加成反应的有(填序号):____________。
(3)写出第①步反应的化学方程式:___________________________
写出物质B与新制Cu(OH)2溶液反应的化学方程式:______________________
写出第⑥步反应的化学方程式:_______________________________
某烃的一种同分异构体,核磁共振氢谱测得分子中只有一个吸收峰,则该烃的分子式可能为( )
| A.C6H14 | B.C7H16 | C.C8H18 | D.C9H20 |
芳香烃A的相对分子质量为118,以A为原料合成某香料中间体G的路线如下:

(1)A的分子式为 ,C中官能团的名称是 。
(2)E→F为消去反应,该反应的反应条件为 。I的结构简式为 。
(3)写出下列转化的化学方程式:
①E→H ;②F→G 。
(4)E有多种同分异构体,写出符合下列条件的同分异构体的结构简式: 。
①分子内含有苯环,核磁共振氢谱有4个吸收峰;
②既能与NaHCO3溶液反应产生气体,又能与FeCl3溶液发生显色反应。