根据下列有机物转化流程回答: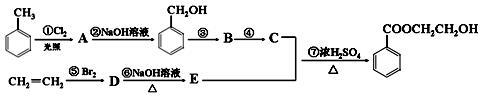
(1)写出A的结构简式:____________。
(2)属于取代反应的有(填序号):。属于加成反应的有(填序号):____________。
(3)写出第①步反应的化学方程式:___________________________
写出物质B与新制Cu(OH)2溶液反应的化学方程式:______________________
写出第⑥步反应的化学方程式:_______________________________
根据下列有机物转化流程回答: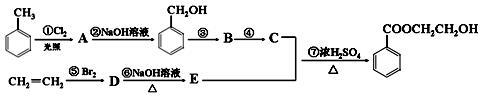
(1)写出A的结构简式:____________。
(2)属于取代反应的有(填序号):。属于加成反应的有(填序号):____________。
(3)写出第①步反应的化学方程式:___________________________
写出物质B与新制Cu(OH)2溶液反应的化学方程式:______________________
写出第⑥步反应的化学方程式:_______________________________