根据图示填空

已知:CH3COOH+C2H5OH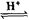 CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)化合物A含有的官能团是 。
(2)1mol A与2mo H2反应生成1moE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)F的结构简式是 。
根据图示填空

已知:CH3COOH+C2H5OH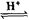 CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)化合物A含有的官能团是 。
(2)1mol A与2mo H2反应生成1moE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)F的结构简式是 。