常温下,若溶液中由水电离产生的 c(H+)=1×10-13 mol/L,满足此条件的溶液中,一定不能大量共存的离子组是( )
| A.K+、Na+、Cl-、HCO3- | B.Na+、Al3+、NO3-、SO42- |
| C.K+、Na+、Cl-、S2- | D.K+、NH4+、SO42-、NO3- |
有人曾建议用AG表示溶液的酸度,AG 的定义为: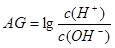 ,室温下实验室用0.01mol∙L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述正确的是
,室温下实验室用0.01mol∙L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述正确的是
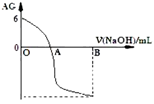
| A.A 点时加入氢氧化钠溶液体积为20 mL |
| B.OA 段溶液中:c(CH3COO-)> c(CH3COOH) |
| C.室温时 0.01 mol/L的醋酸溶液 pH=4 |
| D.若B点时加入NaOH溶液为40 mL,所得溶液中:c(CH3COO-)+ c(CH3COOH) = c(OH-) |
有机物A为饱和多元醇,将13.6g A在20.0L纯O2(过量)中充分燃烧并使反应后的气体依次缓缓通过浓硫酸和碱石灰后,测得气体体积分别为17.76L和6.56L(所有气体体积均在标准状况下测定)。A的分子式为 。又知A中含有2种氢原子,则A的结构简式为 。
已知使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3)],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化成烷烃。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.02 mol CaC2的电石和1.60 g含杂质18.7 %的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL。试回答有关问题。
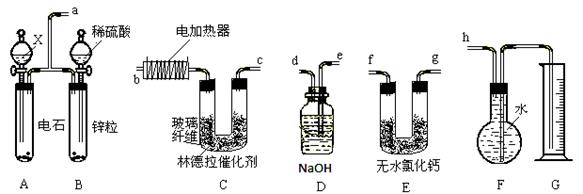
(1)所用装置的连接顺序是 (填各接口的字母)。
(2)写出A、C中所发生的两个反应的化学方程式(有机物写结构简式):
A
C
(3)为减慢A中的反应速率,X应选用__________________。
(4)F中留下的气体除含少许空气外,还有______________________。
(5)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为___________。
推断题
I、如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:

(1)写出反应类型:④ ,⑤ 。
(2)反应②的条件是_______________;
(3)写出化学方程式:B→C______________________。
II、化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:

①A分子中的官能团名称是_________ 。
②D→E的现象是 。
③A只有一种一氯取代物B。写出由A转化为B的化学方程式:_______________;
④A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是________。
I、右图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
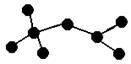
(1)用系统命名法命名 。
(2)M的一氯代物有 种。
(3)含有一个甲基和一个乙基的M的同分异构体有 种。
Ⅱ、利用右图装置还可以验证醋酸、苯酚、碳酸的酸性强弱。

(4)A中固体试剂是 (选填字母);
a.醋酸钠 b.碳酸氢钠 c.苯酚钠
(5)C中反应的化学方程式是: ;
(6)有同学认为没有B装置,也可以验证酸性的强弱,
这种认为是不合理的,原因是 。
 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:

则下列说法正确的是( )
A. 的分子式为C4H4O 的分子式为C4H4O |
| B.A的结构简式是CH2=CHCH2CH3 |
| C.A能使高锰酸钾酸性溶液褪色 |
| D.①、②、③的反应类型分别为卤代、水解、消去 |
已知卤代烃可以跟金属钠反应生成碳链较长的烃,如:CH3Cl + 2Na + CH3Cl → CH3—CH3 + 2NaCl,现有CH3CH2Br和CH3—CHBr—CH3的混合物与金属钠反应后,不可能得到的烃是 ( )
| A.2—甲基丁烷 | B.2—甲基戊烷 | C.2,3—二甲基丁烷 | D.丁烷 |
某同学在一次实验中发现:把新制氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时溶液的红色突然消失。
(1)知识储备:将氯气通入水中的化学方程式为 ;
(2)探究“溶液的红色突然消失”的原因:
①猜想:a.是氯水中的盐酸中和了NaOH,使酚酞由红色变成无色;
b.是 。
②设计实验:往已褪色的溶液中连续滴加NaOH溶液至过量,若现象为 ,则证明“猜想a”正确;若现象为 ,则证明“猜想b”正确。
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。

请回答:
(1)写出A与B反应的化学方程式: 。
(2)写出第④步反应的离子方程式为 。
(3)写出向F溶液中通入B时发生反应的离子方程式 。
(4)写出Cu与D溶液反应的离子方程式 。
(5)用离子方程式表示D溶液中滴加KSCN溶液显红色的原因 。
(6)向F溶液中滴入NaOH溶液过程中发生的氧化还原反应化学方程式为 。
在某稀溶液中含有0.2molHNO3和xmolH2SO4,向其中加入19.2g铜粉,充分反应后产生的气体在标注状况下的体积为4.48L,则x值至少为
| A.0.6 | B.0.4 | C.0.3 | D.0.2 |
27.4g的Na2CO3与NaHCO3的固体混合物,在空气中加热片刻后固体混合物质量变为24g,将所得的固体混合物溶于200ml、2mol•L﹣1的稀盐酸恰好完全反应,并完全放出二氧化碳气体,将所得的溶液蒸干、灼烧称量,其质量为()
| A.11.7g | B.23.4 g | C.26.5g | D.58.5g |