在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.87 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.316 |
158 |
| 硝酸银 |
0.075 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)硫酸钾在水中的电离方程式为______________________。
(3)配制1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、__________、__________、_________。(在横线上填写所缺仪器的名称),需要高锰酸钾________mol
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。
仔细观察下图,根据题意对图中两极进行必要的连接后填空:
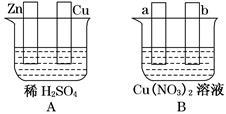
(1)若在图A中,使铜片上冒H2气泡。则加以必要的连接后的装置叫 。
(2)若在图B中,a、b为惰性电极,进行必要的连接后使b极析出1.28g铜,则a极析出的物质的物质的量为 ,反应的总反应方程式为 。
(3)若将图A中Zn、Cu两极与图B中a、b作必要的边接后,也能产生与(1)、(2)完全相同的现象,则Cu极连_______极(填a或b)。经过一段时间后,停止反应并搅匀溶液,图B中溶液的pH_________(填写“升高”、“降低”或“不变”),欲使溶液恢复至与反应前完全一致,则应加入的一定量的物质是_________。
| A.CuO | B.Cu(OH)2 | C.Cu2(OH)2CO3 | D.CuCO3 |
实验题
在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,请完成下面的测定实验分析报告。
(一)测定目的:测定××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(三)实验用品及试剂:仪器和用品(自选,略)
试剂:指示剂 ① (填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2)用 ② (填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的 ③ (填部位),右手摇动锥形瓶,眼睛注视 ④ ,直到滴定终点。滴定至终点时的现象是 ⑤ 。
(4)数据记录与处理:若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是 ⑥ mg/L。
(五)问题讨论:从分析数据看,此软包装橙汁是否是纯天然橙汁? ⑦ (填“是”或“不是”或“可能是”)。制造商最可能采取的做法是 ⑧ (填编号):
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
室温下,某同学将某一元酸HX和NaOH溶液等体积混合,测得两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HX物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
c2 |
c2 |
pH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若HX为强酸,则a 7(填“>”“<”或“=”);若HX为弱酸,则a 7(填“>”“<”或“=”)。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是 酸(填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L。
在恒容的密闭容器中,进行化学反应CO2 (g)+H2 (g) CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
| t / ℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)正反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________(多选无分)。
A.容器中压强不变 B.混合气体中c (CO)不变
C.v正(H2)=v逆(H2O) D.c (CO2)="c" (CO)
(4)某温度下,平衡浓度符合下式:c (CO2)·c (H2)="c" (CO)·c (H2O)。可判断此时的温度为________℃。
| 实验 编号 |
HX物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
c2 |
c2 |
pH=10 |
向一定量的NaOH固体中加入由硫酸铜和硫酸组成的混合物的溶液,充分搅拌,恰好完全反应,有蓝色沉淀生成,过滤,所得滤液的质量与加入的原混合物溶液的质量相等。则与硫酸铜反应的氢氧化钠和与硫酸反应的的氢氧化钠的物质的量之比为?
常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如右图所示:
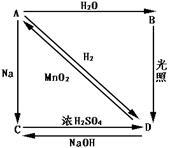
(1)分别写出下列物质的化学式:
B D
(2)试写出有关化学方程式:
A→B
D→A
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
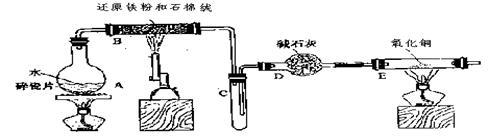
(1) 烧瓶底部放置了几片碎瓷片,
碎瓷片的作用是 。
装置B中发生反应的化学方程式是____________________________ ____。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是_ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
简述检验滤液中Fe3+的操作方法____________________________。
(4) 该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
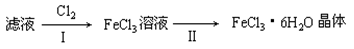
步骤I中通入Cl2的作用是________________________________。
把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
| A.3:2 | B.1:1 | C.2:3 | D.1:2 |
化学小组同学依据化学反应Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与110 mL 98%的浓H2SO4充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。(F中为无水硫酸铜)
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与110 mL 98%的浓H2SO4充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。(F中为无水硫酸铜)
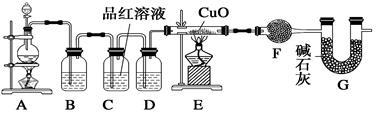
请回答下列问题:
(1)装置A中添加液体的仪器名称为 ; 98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度是 ;
(2)装置B是为了吸收SO2,则不能选用下列试剂中的 (填序号);
A.NaOH溶液 B.浓H2SO4 C.KMnO4溶液
(3)装置D的作用是 ;
(4)可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是 。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+ 5种离子,现进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有的离子是 ,一定不含的离子是__________,还有一种离子不能确定是否存在,要检验这种离子的实验方法是 。
洪灾过后,需要对饮用水进行杀菌消毒,防止传染性疾病的爆发。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
(2)实验室常用软锰矿(主要成分为MnO2)和浓盐酸反应制Cl2,其化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,其中,氧化产物是 (填化学式),在每摩尔参加反应的盐酸中,作还原剂的盐酸的物质的量为 mol。
MnCl2+Cl2↑+2H2O,其中,氧化产物是 (填化学式),在每摩尔参加反应的盐酸中,作还原剂的盐酸的物质的量为 mol。
某有机物的结构简式如图所示,下列有关物质的说法正确的是
| A.该物质的分子式是C9H11O |
| B.该物质分子中的所有C原子可以共面 |
| C.滴入KMnO4(H+)溶液,可观察到紫色褪去,能证明结构中存在碳碳双键 |
| D.1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别是3mol、4mol |
下图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略。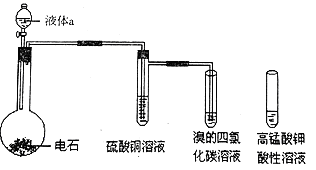
(1)实验室制取乙炔时,分液漏斗中的液体a通常是__________________________;
(2)圆底烧瓶中生成乙炔的化学方程式是__________________________;
(3)硫酸铜溶液的作用是____________________________;
(4)将通过硫酸铜溶液的气体通入溴的四氯化碳溶液中,反应的方程式是_______________;
若改为通入酸性高锰酸钾溶液中,现象是__________________________________;
(5)乙炔与氯化氢加成可以生成氯乙烯聚合生成聚氯乙烯的方程式是__________________。
下图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素。
(1)该有机物的分子式为_____________________________;
(2)往该有机物溶液中滴入FeCl3溶液,可以看到溶液呈紫色,可以确定该有机物的结构简式为_______;
(3)该有机物与浓溴水反应的方程式为_______________________________;
(4)往该有机物的水溶液一般呈白色浑浊状,往溶液中滴入NaOH溶液,现象是______________,反应方程式为_______________________。