下列有关物质检验的实验结论正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| B |
向某溶液中加入2滴KSCN溶液,溶液不显红色, 再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
| C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
| D |
将某物质的溶液滴加酚酞试液中,溶液呈红色 |
该物质一定是碱 |
下列测定常温下1mo1氢气体积的操作中,使结果偏大的是
| A.镁带中混有与酸不反应的杂质 | B.装置接口连接处有气体泄漏 |
| C.液体量瓶刻度读数未扣去硫酸的体积 | D.硫酸注入量不足,镁带未反应完全 |
用己知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确是
| A.滴定前,没有逐出滴定管下口的气泡 |
| B.用甲基橙作指示剂,指示剂刚变色,就停止滴定 |
| C.酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 |
| D.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
下列情况中不能说明X的非金属性比Y强的是
| A.同主族时X原子的电子层数比Y原子的电子层数少 |
B.X2+H2 2HX ,Y2+H2 2HX ,Y2+H2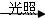 2HY 2HY |
| C.气态氢化物水溶液的酸性X比Y强 |
| D.X的单质能将Y从NaY溶液中置换出来 |
下列事实中,能用勒夏特列原理解释的是
| A.配制FeSO4溶液时,加入一些铁粉 |
| B.500℃左右比室温更有利于合成氨的反应 |
| C.实验室常用排饱和食盐水的方法收集氯气 |
| D.由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 |
将氯化铝溶液和硫酸铝溶液分别蒸干、灼烧,最后得到的固体是
| A.都是Al2O3 | B.依次为AlCl3、Al2(SO4)3 |
| C.都是Al(OH)3 | D.依次为Al2O3、Al2(SO4)3 |
苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,榨汁时加入维生素C可有效防止这种现象发生,说明维生素C具有
| A.氧化性 | B.还原性 | C.碱性 | D.酸性 |
在pH=13的无色溶液中能大量共存的是
| A.NH4+、SO42-、Cl- |
| B.Al3+、NO3-、Cl- |
| C.K+、MnO4-、SO42- |
| D.Na+、CO32-、NO3- |
下列离子方程式正确的是
| A.铁和稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| B.氯气和溴化钠溶液反应:C12+2Br-→2C1—+Br2 |
| C.氢氧化钡和稀硫酸反应:SO42-+Ba2+→BaSO4↓ |
| D.醋酸和碳酸钙反应:2H++CaCO3 →Ca2++CO2↑+H2O |
在标有“20℃,25mL”的滴定管内装溶液至刻度“0”时,管内液体的体积
| A.约为5mL | B.大于25mL | C.等于25mL | D.小于25mL |
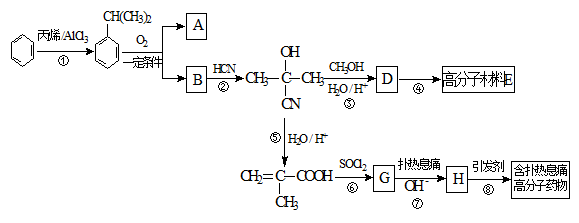
高分子材料E和含扑热息痛高分子药物的合成流程如下图所示:
已知:I.含扑热息痛高分子药物的结构为: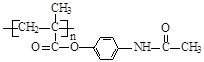 。
。
II.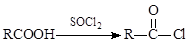
III.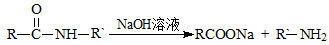
试回答下列问题:
(1)①的反应类型为____________,G的分子式为____________。
(2)若1 mol  可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
(3)反应②为加成反应,则B的结构简式为__________;扑热息痛的结构简式为______________。
(4)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式 。
(5)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32% 。D有多种同分异构体,其中属于链状酯类,且能发生银镜反应的同分异构体有_______种(考虑顺反异构)。
实验题组
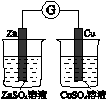
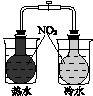
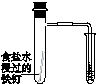
Ⅰ.下图所示的实验,能达到实验目的的是 。
| A |
B |
C |
D |
 |
 |
 |
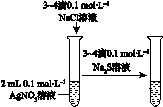 |
| 验证化学能 转化为电能 |
验证温度对化学平衡的影响 |
验证铁 发生析氢腐蚀 |
验证AgCl 溶解度大于Ag2S |
Ⅱ.某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)向FeCl3溶液中通入一定量的SO2,反应的离子方程式: ;
(2)检验吸收液中SO42–的方法: ;
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红溶液。
L-1KSCN溶液、品红溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 |
(1) 若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立。 |
| 步骤2: |
|
无机推断题组(一题多变题组)
已知:A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出E中含有的化学键类型 ;已知1molA与水反应放出283.5kJ的热量,试写出A与水反应的热化学反应方程式 ;
(2)若A 为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则单质A与H2O反应的离子方程式 。
(3)若A 为淡黄色粉末,回答下列问题:
①1molA与足量的H2O充分反应时,转移电子总数为 。
②若X为非金属单质,通常为黑色粉末,写出D的结构式 ;
(4)若A为氧化物,X是Fe,溶液D加入KSCN溶液变红。
①A与H2O反应的离子方程式 。
②请用离子方程式表示D盐的净水原理 。
某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
下列分析判断正确的是
| A.分离提纯有机物丙宜在NaOH热溶液中进行 |
| B.PbCl2的作用是提高反应物的活性,加快反应速率 |
| C.可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 |
| D.利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |