某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒,其中N2是反应产物。下列判断正确的是
| A.该反应的还原剂是Cl- | B.消耗1mol还原剂,转移6mol电子 |
| C.反应后溶液的酸性明显增强 | D.氧化剂与还原剂的物质的量之比为2∶3 |
下列指定反应的离子方程式正确的是
| A.氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| B.NaClO溶液中通入少量SO2 :3ClO-+SO2+H2O=Cl-+SO42-+2HClO |
| C.向稀NH4HCO3溶液中加入过量NaOH溶液:NH4++OH-=NH3·H2O |
| D.10 mL 0.5 mol·L-1的KAl(SO4)2溶液与20 mL 0.5 mol·L-1的Ba(OH)2溶液混合反应: |
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
.随着人们生活节奏的加快,方便的小包装食品己被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,可用适当方法在包装袋中装入
| A.无水硫酸铜、蔗糖 | B.生石灰、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
下列关于合金的说法,正确的是
| A.合金不能导电、传热 |
| B.合金属于纯净物 |
| C.合金没有延展性 |
| D.合金的很多性能与组成它们的纯金属不同 |
下列说法中不正确的是
| A.钠保存在石蜡油或煤油中 |
| B.氯水保存在棕色试剂瓶中 |
| C.保存FeSO4溶液需加入少量铁粉 |
| D.实验室盛装NaOH溶液的试剂瓶用玻璃塞 |
下列各组离子中,能在同一溶液中大量共存,加入一小块钠后仍能大量共存的是
| A.Na+、K+、Cl-、CO32- | B.Cu2+、Na+、SO42-、CO32- |
| C.Ba2+、K+、Cl-、SO42- | D.K+、Na+、HCO3-、NO3- |
用NA表示阿伏伽德罗常数的值,下列说法正确的是
| A.在标准状况下,11.2 L H2O中含有的分子数为0.5 NA |
| B.32 g O2所含的原子数为2 NA |
| C.1 mol/L NaCl溶液中含有的Na+的数为NA |
| D.1 mol Na2O2中离子总数为4 NA |
下列物质分类的正确组合是
| |
碱 |
酸 |
盐 |
酸性氧化物 |
| A |
纯碱 |
硝酸 |
烧碱 |
二氧化硫 |
| B |
烧碱 |
硫酸 |
食盐 |
一氧化碳 |
| C |
苛性钠 |
醋酸 |
石灰石 |
水 |
| D |
苛性钾 |
碳酸 |
碳酸氢钠 |
二氧化碳 |
某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
常温下,下列各组离子一定能在指定溶液中大量共存的是
| A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
B. =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3- =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3- |
| C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |
| D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32- |
已知醋酸和盐酸是日常生活中极为常见的酸。
(1)常温常压,在 pH=5的稀醋酸溶液中,c(CH3COO‾)=_____________;下列方法中,可以使0.10 mol/LCH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol/L的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol/L
e.加入少量氯化钠固体
f.加入少量0.10 mol/L的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)__________V(醋酸),反应的最初速率为:
υ(盐酸)_________υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va________Vb;溶液中各离子的浓度按照由大到小排序为_________。
(4)已知:90℃时,水的离子积常数为Kw=38×10‾14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)。
T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列叙述正确的是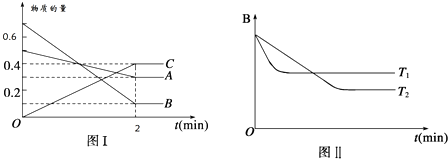
A.2min内A的化学反应速率为0.1 mol/(L•min)
B.在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C.在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D.图(I)中,达平衡时,A的体积分数为37.5%
下列叙述正确的是
| A.氯化铵、次氯酸钠、醋酸铵、硫酸钡都是强电解质 |
| B.电解、电泳、电离、电化学腐蚀均需在通电条件下才能进行 |
| C.红宝石、水晶、钻石的主要成分都是二氧化硅 |
| D.福尔马林、水玻璃、氨水、胆矾均为混合物 |
早期发现的一种天然二十面体准晶颗粒由三种Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)可通过 方法区分晶体、和非晶体。
(2)基态Fe原子有 个未成对电子,Fe3+的电子排布式为 。可用硫氰化钾检验Fe3+,形成的配合物的颜色为 。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为 ,1mol乙醛分子中含有的σ键的数目为 。乙酸的沸点明显高于乙醛,其主要原因是 。
(4)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g·cm-3(不必计算出结果)。