右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O

(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
研究发现,含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(1)雾霾中能形成酸雨的物质是_____________。
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
4NO(g)+6H2O(g) △H =" -905.48" kJ·mol-1
N2(g)+O2(g) 2NO(g) △H =" +180.50" kJ·mol-1
2NO(g) △H =" +180.50" kJ·mol-1
①下列表示NH3(g)与NO(g)在一定条件下反应,生成无污染气体的能量转化关系示意图正确的是:___________(填字母)

② 右图是反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。
5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是_________,原因是_________。

(3)右图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,

① 阴极的电极反应式是 。
② 物质A是_____________(填化学式),理由是_________________________。
(4)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,请解释:

① 随空/燃比增大,CO和CxHy的含量减少的原因是 。
② 当空/燃比达到15后,NOx减少的原因可能是_____________。
某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极)。电解过程中,X极产生了红棕色气体,则下列说法不合理的是
| A.a极为负极,b极为正极 |
| B.电解时,Y极附近溶液pH降低 |
| C.相同条件下,阴阳两极气体体积比是2:1 |
| D.X极的电极反应式是:2H++ NO3-+ e-=NO2↑ + H2O |
下列关于电解池的叙述中不正确的是( )
| A.与电源正极相连的是电解池的阴极 |
| B.与电源负极相连的是电解池的阴极 |
| C.在电解池的阳极发生氧化反应 |
| D.电子从电源的负极沿导线流入电解池的阴极 |
ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂,制备ClO2的新工艺是电解法。
(1)如图表示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式:__________________________________;图中b电极为_____________(填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol,阴极区pH________(填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________________。
如图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

| A.该过程是电能转化为化学能的过程 |
| B.一段时间后,①池中n(KHCO3)不变 |
| C.一段时间后,②池中溶液的pH 一定下降 |
| D.铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O |
如图所示,a、b、c均为石墨电极,d为碳钢电极, 通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )

| A.甲、乙两烧杯中溶液的pH均保持不变; |
| B.甲烧杯a电极反应式为:4OH― - 4e- = O2↑+ 2H2O |
| C.电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况下) |
21世纪是钛的世纪。在800℃~1 000℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )

| A.a为电源的正极 |
| B.石墨电极上发生还原反应 |
| C.阴极发生的反应为:TiO2+4e-=Ti+2O2- |
| D.每生成0.1 mol钛,转移电子0.2 mol |
工业上制取氢气除电解水外还有多种方法.
(1)工业上可用组成为K2O•M2O3•2RO2•nH2O的无机材料纯化制取氢气.
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R在周期表的位置为 .
②常温下,不能与M单质发生反应的是 (填序号).
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)工业上也可利用化石燃料开采、加工过程中产生的H2S废气制取氢气.
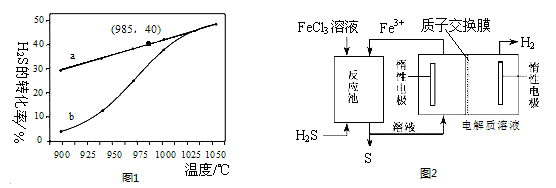
①高温热分解法 已知:H2S(g)⇌H2(g)+S(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol•L﹣1测定H2S的转化率,结果见图1.图中a为H2S的平衡转化率与温度关系曲线,b为表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率的变化曲线.据图计算985℃时H2S按上述反应分解的平衡常数K= ;随着温度的升高,曲线b向曲线a逼近的原因是
②电化学法:该法制取氢气的过程如图2所示.反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 .
反应后的溶液进入电解池,电解总反应的离子方程为 .
(3)H2S在足量氧气中燃烧可以得SO2,若在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol.若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,SO3的物质的量的取值范围为 mol.
下列说法正确的是
| A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
B.用惰性电极电解MgCl2溶液的离子方程式为:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| C.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
| D.嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体。 |
如下图所示:
(1)a电极是_________(填“阴极”或“阳极”),b电极是_________(填“阴极”或“阳极”)。
(2)当电解NaCl溶液时:
①a电极的电极反应为________________,该反应是_______(填“氧化”或“还原”)反应;
②b电极的电极反应为______________,该反应是_________(填“氧化”或“还原”)反应。
(3)当电解精炼铜时:
①a电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________;
②b电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________。
用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是( )
| A.稀NaOH溶液 | B.HCl溶液 | C.CuSO4溶液 | D.AgNO3溶液 |
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
(1)A12O3与H2SO4发生反应的离子方程式是____________。
(2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
(3)将溶液A电解得到液体聚合硫酸铝铁。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
① 阴极室的电极反应式是__________。
② 电解过程阳极室溶液pH的变化是____________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理____________。
氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答氯碱工业的如下问题:
(1)原料粗盐中常含有泥沙和Ca2+、Mg2+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是___________(填序号)
(2)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系示意图如下(其中的电极均为惰性电极,物料进出口未全部标出)。

①图中A是 (填化学式),分析比较图示中两处氢氧化钠质量分数x%______y%
(填“>”或“<”或“=”)。
②写出燃料电池中正极上发生的电极反应: 。
③标准状态下,当燃料电池消耗22.4LO2时,通过电池中阳离子交换膜的阳离子的物质的量为 mol。
④这样设计的主要节(电)能之处在于 。