对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
| A.使用合适的催化剂可以加大反应速率 |
| B.升高温度可以增大反应速率 |
| C.增大N2浓度可以使H2转化率达到100℅ |
| D.增大N2浓度可以增大反应速率 |
一定量的铁粉与足量2mol/L盐酸反应,为了加快反应速率且不影响产生氢气的量,可向溶液中加入①3mol/L的硝酸溶液 ②少量CuSO4(s)③加入一定量的铜 ④少量CH3COONa(s)
⑤对溶液加热(假定溶质不挥发) ⑥向反应液中通入HCl气体 ⑦加入过量铁粉 ⑧将铁粉改为铁片
| A.②③④⑤⑥ | B.③⑤⑥ | C.①③⑤⑥⑦ | D.③⑤⑥⑧ |
下列叙述正确的是
| A.升高温度和增大浓度都会加快反应速率,其原因是增加了活化分子的百分率 |
| B.常温下,pH=1的水溶液中,Na+、NO3-、HCO3-、Fe2+可以大量共存 |
C.NaHS的电离方程式为:NaHS Na++HS— Na++HS— |
| D.C(石墨,s)=C(金刚石,s);△H>0,所以石墨比金刚石稳定 |
研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
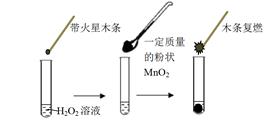
(1)甲同学欲用右图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验 (填“能”或“不能”)达到目的,原因是 。
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50 mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
| MnO2的质量/g |
0.1 |
0.2 |
0.4 |
| 40s末O2体积/mL |
49 |
61 |
86 |
由此得出的结论是 ,原因是 。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
| 试管 |
Ⅰ |
Ⅱ |
Ⅲ |
| 滴加试剂 |
5滴0.1 mol·L-1 FeCl3 |
5滴0.1 mol·L-1 CuCl2 |
5滴0.3 mol·L-1 NaCl |
| 产生气泡情况 |
较快产生细小气泡 |
缓慢产生细小气泡 |
无气泡产生 |
结论是 ,实验Ⅲ的目的是 。
(4)① 查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是 和 (按反应发生的顺序写)。
② 在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是 。
根据下列有关实验得出的结论一定正确的是
| 选项 |
方法 |
结论 |
| A |
实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 |
可以加快制备氢气的反应速率 |
| B |
向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 |
氧化性:H2O2>Fe3+ |
| C |
相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 |
反应速率: 粉状大理石>块状大理石 |
| D |
吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行 |
则该反应的△S<0 |
下列图示与对应的叙述相符的是
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线) |
| C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大 |
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_______________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_____________________。
(3)实验①和②的目的是______________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
分析上图能够得出的实验结论是__________________________。
右图是关于反应A2(g)+3B2(g)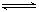 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是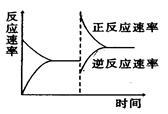
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得下图,则曲线a、b、c、d所对应的实验组别可能是

| 组别 |
c(HCl)(mol/L) |
温度(℃) |
状态 |
| 1 |
2.0 |
25 |
块状 |
| 2 |
2.5 |
30 |
块状 |
| 3 |
2.5 |
50 |
粉末状 |
| 4 |
2.5 |
30 |
粉末状 |
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液( )
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
设C+CO2  2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2  2NH3(正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3(正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |