偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
| A.偏二甲肼的摩尔质量为60 g | B.1 mol偏二甲肼的质量为60 g/mol |
| C.1 mol偏二甲肼的质量为60 g | D.6 g偏二甲肼(C2H8N2)含有NA个分子 |
下列说法正确的是( )
| A.2 mol·L-1 KCl溶液与1 mol·L-1 K2SO4溶液等体积混合后,c(K+)为2 mol·L-1 |
| B.120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20 g |
| C.22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mol·L-1 |
| D.把5 g胆矾溶于45 g水中,所得溶液溶质的质量分数为10% |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.在12 g单层石墨中,含六元环的数目为1NA |
| B.50mL 18.4mol·L-1浓硫酸与足量铜加热充分反应,生成SO2分子的数目为0.46 NA |
| C.42 g由乙烯和环丙烷组成的混合气体中,碳氢键的数目为6NA |
| D.1mol过氧化钠与足量CO2充分反应,转移的电子数为2NA |
右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

| A.该硫酸试剂的物质的量浓度为18.4 mol/L |
| B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 |
| C.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol |
| D.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L |
设阿伏加德罗常数的数值为N,下列说法正确的是
| A.1molCl2溶于水反应,反应转移电子数为NA |
| B.56g晶体硅中含有硅分子数为2NA |
| C.1 mol Cu和足量稀硝酸反应产生nA个NO分子 |
| D.标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2NA |
已知:MnO2+4HCl MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
(1)反应耗用MnO2的质量;(2)被氧化的HCl物质的量;(3)跟浓盐酸的物质的量浓度。
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(Ca2C2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液定量反应即可测定血样样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。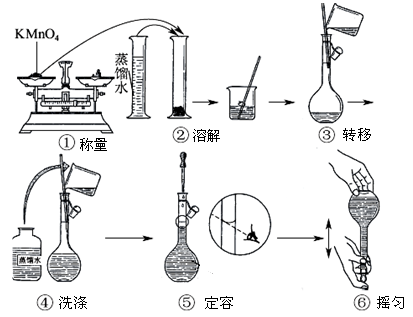
【实验探究一】配制酸性KMnO4标准溶液。如上图所示是配制100mL 酸性KMnO4标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有____________(填序号);
(2)其中确定100mL溶液体积的容器是____________(填名称);
(3)如果按照图示的操作所配制溶液进行实验,在其他操作均正确的情况下,所得KMnO4溶液浓度将_________(填“偏大”或“偏小”)。
【实验探究二】测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L 酸性KMnO4溶液与之反应,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mnx++10CO2↑+8H2O则式中的x=_________
(5)经过计算,血液样品中Ca2+的浓度为___________ mg/cm3。
设NA为阿伏加罗常数的值,下列说法正确的是
| A.标准状况下,22.4LCH4中含有氢原子数目为4NA |
| B.1molNa2O2中含有的阴离子和阳离子的数目为2NA |
| C.0.1mol/LCu(NO3)2溶液中含有的NO3-数目为0.2NA |
| D.28gN2中所含的原子数目为NA |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B.标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA |
| C.常温常压下,18gH2O中含有的原子总数为3NA |
| D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2LSO3所含的分子数为0.5NA |
| B.12g石墨和C60的混合物中质子总数一定为6NA |
| C.25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子 |
| D.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
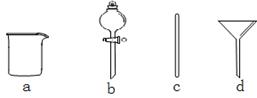
实验室需要0.1 mol·L-1NaOH溶液480mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
| A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡 |
| B.在盛有NaOH固体的烧杯中加入适量水溶解 |
| C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,反复上下颠倒,摇匀 |
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于__________、后用于__________。
(4)根据计算用托盘天平称取的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1 mol·L-1(填“大于”“小于”或“等于”)。
下列说法错误的是
| A.从1L1 mol·L-1的氯化钠溶液中取出10ml,其浓度仍是1mol·L-1 |
| B.配制0.5L 10 mol·L-1的盐酸,需要氯化氢气体112L(标准状况) |
| C.0.5 L 2 mol·L-1的氯化钡溶液中,钡离子和氯离子总数为1.806×1024 |
| D.10g 98%硫酸(密度为1.84g/cm3)与10mL18.4 mol·L-1硫酸的浓度是不同的 |
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
| A.常温常压下,48gO3含有的氧原子数为3NA |
| B.Na在O2中燃烧时,若转移0.2NA电子,则消耗1.12LO2(标况)。 |
| C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等 |
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为__________mol·L-1。
(2)下列容量瓶的使用方法中,不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.200 mol·L-1的稀盐酸。
① 该学生需要用量筒量取________mL上述浓盐酸进行配制。
② 在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有___________
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容。
B.用量筒量取浓盐酸时俯视观察凹液面
C.在容量瓶中定容时俯视刻度线。
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。