测我国了“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了”
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是_____(填写编号)。
| A.在高温下不融化 | B.在高温下可分解气化 |
| C.在常温下就分解气化 | D.该涂料不可能发生分解 |
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2O4 + N2H4 → N2 + H2O 。请配平该反应方程式:
+ H2O 。请配平该反应方程式:
————N2O4 + ————N2H4 → ————N2 + ————H2O
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。
(3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
①写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似): _______________ ____;_________________________。
②你选择的供氧剂是:_______________。
今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g);ΔH=aKJ·mol-1,
H2(g)+1/2O2(g)=H2O(l);ΔH== bkJ·mol-1,
2H2(g)+O2(g)=2H2O(l);ΔH== ckJ·mol-1,
关于它们的下列表述正确的是
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.a==b | D.2b==c |
下列说法正确的是 ( )
| A.NH4NO3溶于水虽然吸热,但其溶于水是自发过程 |
| B.过热液体(温度高于沸点)会自发转变成气体,可用焓变解释。 |
| C.对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最大 |
| D.有序火柴散落的自发过程可用能量判据解释 |
嫦娥二号运载工具长三丙火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂 液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出257KJ的热量。
液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出257KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是 KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点 。
(原创题)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是__________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________
(填“增大”“减小”“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1_______,E2_______(填“增大”“减小”“不变”)。
(4)已知下列热化学方程式:
①H2(g) +1/2O2(g)=H2O(l);ΔH="-285" kJ·mol-1
②H2(g) +1/2O2(g)=H2O(g);ΔH="-241.8" kJ·mol-1
③C(s) +1/2O2(g)=CO(g);ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g);ΔH="-393.5" kJ·mol-1
回答下列问题:
① 燃烧1gH2生成液态水,放出的热量为 。
②写出CO燃烧热的热化学方程式 。
已知:

根据以上热化学方程式判断,下列说法正确的是
| A. CO的燃烧热为283kJ |
| B.由题可知CO比CO2稳定 |
C. |
D. 与 与 反应放出509kJ热量时,电子转移数为 反应放出509kJ热量时,电子转移数为 |
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值将_______
(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,
与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由________________________________________________________
下列叙述中完全正确的是
| A.乙醇标准燃烧热的热化学方程式:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol |
B.对于反应PCl5(g) PCl3(g)+Cl2(g),达到平衡后,若保持温度容器容积不变,又加入一定量的PCl5(g),则该平衡向正方向移动,但平衡时PCl5(g)的转化率减小 PCl3(g)+Cl2(g),达到平衡后,若保持温度容器容积不变,又加入一定量的PCl5(g),则该平衡向正方向移动,但平衡时PCl5(g)的转化率减小 |
| C.1.0mol/L的Fe(NO3)2溶液和2.0mol/L的HNO3溶液等体积混合后, c(NO3-)=2.0mol/L |
| D.1molCl2发生反应时,转移的电子数一定是2NA |
利用盖斯定律回答下列问题:
已知热化学方程式
C(s、金刚石)+O2(g) —→ CO2(g); △H=-395.4kJ·mol—1
C(s、石墨)+O2(g) —→ CO2(g); △H = -393.5kJ·mol—1
由金刚石转化为石墨的热化学方程式为 ,由热化学反应方程式看来,更稳定的碳的同素异形体是 。
下列说法不正确的是
| A.在化学反应中,化学能只可以转化为热能 |
| B.合成氨工业中使用铁作催化剂以改变该反应的限度 |
| C.SO2和O2合成SO3的反应中,增大压强,该反应速率减小 |
| D.化学键的断裂和形成是化学反应中能量变化的主要原因 |
已知反应A+B = C+D的能量变化如下图所示,下列说法正确的是
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H= 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是: 。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)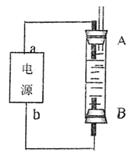
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将 所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
a |
b |
c |
1 |
①实验1中,以v(H2)表示的平均反应速率为 。
②该反应的正反应为 (填“吸”或“放”)热反应。
(4)将2.4g碳(碳的相对原子质量为12)在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质的化学式是 ;溶液中所含离子的物质的量浓度由大到小的顺序为: 。
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池.
①当电解质溶液为稀硫酸时:
Cu电极是_____(填“正”或“负”)极,其电极反应为____,该反应是____(填“氧化”或“还原”)反应;
②当电解质溶液为浓硝酸时:
Cu电极是_____极,其电极反应为__________,该反应是_____反应.
(2)电解是将 能转化为 能。请写出电解硫酸铜溶液的总化学方程式____________
(3)燃烧氢气时耗氧量小,发热量大.已知4克H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为: .
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极发生的电极反应式 。
0.3 mol硼烷(B2H6)在氧气中完全燃烧生成固体B2O3和液态水,放出649.5 kJ热量。下列判断正确的是
| A.该反应是非氧化还原反应 |
| B.在理论上可以利用该反应的原理做成燃料电池 |
C.该反应的热化学方程式为:B2H6+3O2="==" B2O3(s)+3H2O(l); H="-2165" kJ/mol H="-2165" kJ/mol |
| D.每生成18g水,该反应转移2mol电子 |