四川省乐山市高中高一下期期末教学质量检测化学试卷
下列各组物质的有关判断中,正确的是
| A.H2O与D2O属同系物 | B.液溴和溴蒸气是同素异形体 |
| C.O2与O3属同位素 | D.乙醇与二甲醚(CH3OCH3)属同分异构体 |
对于密闭容器中一定条件下的反应:N2 + 3H2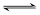 2NH3,下列说法正确的是
2NH3,下列说法正确的是
| A.增加N2的量,可以加快反应速率 |
| B.当N2和H2全部转化为NH3时,反应达到最大限度 |
| C.达到平衡时,H2和NH3的浓度比一定为3∶2 |
| D.分别用N2和NH3来表示该反应的速率时,数值大小相同 |
下列实验中,不易观察到明显变化的是
| A.把绿豆大的钾投入少量水中 |
| B.把一段打磨过的镁带放入少量冷水中 |
| C.把溴水加入到淀粉KI溶液中 |
| D.氢气和氯气等体积混合后强光照射 |
将10mol A和5mol B放入10L真空箱内,某温度下发生反应:3A(气)+B(气) 2C(气)在最初0.2s内,消耗A的平均速率为0.06mol·(L·S)-1.则在0.2s时,真空箱中C的物质的量是
2C(气)在最初0.2s内,消耗A的平均速率为0.06mol·(L·S)-1.则在0.2s时,真空箱中C的物质的量是
| A.0.12mol | B.0.08mol | C.0.04mol | D.0.8mol |
下列事实不能说明X元素比Y元素的非金属性强的是
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的核内质子数之和为31,则X、Y、Z是
| A.C Na Si | B.C Mg Al | C.N O S | D.P S O |
有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是
| A.甲>乙>丙>丁 | B.丙>丁>乙>甲 |
| C.丙>丁>甲>乙 | D.丁>乙>甲>丙 |
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是
| A.R一定是共价化合物 |
| B.R一定是离子化合物 |
| C.R可能是共价化合物,也可能是离子化合物 |
| D.R不可能是气态物质,只可能是固态物质 |
CH2 = CHCH2OH可能发生的反应类型有:①加成反应②氧化反应③酯化反应④中和反应
| A.只有①③ | B.只有①②③ | C.只有①③④ | D.只有①② |
下列对营养物质在人体内发生的变化及其对人的生命活动所起的作用的叙述不正确是
A.淀粉 葡萄糖 葡萄糖 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
B.纤维素 葡萄糖 葡萄糖 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
C.油脂 甘油和高级脂肪酸 甘油和高级脂肪酸 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
D.蛋白质 氨基酸 氨基酸 人体所需的蛋白质(人体生长发育、新陈代谢) 人体所需的蛋白质(人体生长发育、新陈代谢) |
在通常条件下,下列各组物质的性质排列正确的是
| A.酸性:H2SO4﹥H3PO4﹥HClO4 |
| B.水溶性:HCl﹥SO2﹥NH3 |
| C.沸点:乙烷﹥戊烷﹥丁烷 |
| D.氧化性:Cl2﹥Br2﹥I2 |
中子数比质子数多1个的原子A,其阳离子An+ 核外有X个电子,则A的质量数为
| A.2(x+n) | B.2(x-n)+1 | C.2(x +n)+1 | D.n+2 |
已知反应A+B = C+D的能量变化如下图所示,下列说法正确的是
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
下列关于甲烷的叙述正确的是
| A.甲烷分子的空间构型是正四面体型,所以,CH2Cl2有两种不同构型 |
| B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色 |
| C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一 |
| D.将甲烷与氯气以体积比1:1的比例混合,光照条件下就可得到比较纯净的CH3Cl |
下列有关物质检验的实验结论正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| B |
向某溶液中加入NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 |
该溶液中一定含有NH4+ |
| C |
将某气体通入溴水中,溴水褪色 |
该气体一定为SO2 |
| D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 |
该物质一定是乙醛 |
室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了30 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL ,则该气态烃的分子式为
| A.C4H6 | B.C2H4 | C.C3H8 | D.C4H8 |
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(1)阴影部分元素N在元素周期表中的位置为 周期 族 。根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为____________;在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”);
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是_____________。
(4)下列说法不正确的是 。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
Ⅰ.由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36 L(标准状况)的气体。问:
(1)负极是 (填“锌”或“铜”),发生 反应(填“氧 化”或“还原”)。
(2)正极的电极反应为
(3)产生这些气体共需转移电子 mol。
Ⅱ.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一金属锂是一种重要的储氢材料,吸氢和放氢原理为: Ⅰ.2Li+H2 2LiH Ⅱ.LiH+H2O===LiOH+H2↑
2LiH Ⅱ.LiH+H2O===LiOH+H2↑
反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
请填空:
(1)写出二甲醚完全燃烧生成二氧化碳和水的化学反应方程式:
__________________________________________________________________。
(2)写出用CO和H2合成甲醇的化学方程式:___________________________________。
(3)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) 。
CO(g)+3H2(g) 。
将1.0 molCH4和2.0 molH2O通人反应室1(容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率v(CH4)=_______________________。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下: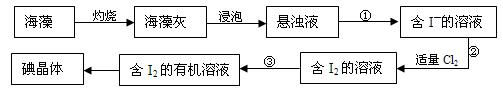
(1)实验操作③的名称是___________,所用主要仪器名称为______________________。
(2)提取碘的过程中,可选择的试剂是________________(已知碘的沸点为184.40C)。
A.酒精(沸点780C) B.四氯化碳(沸点770C)
C.甘油(沸点1900C) D.苯(沸点800C)
(3)操作②的离子方程式为 ;该步骤的含I2溶液中生成有少量ICl,为使碘全部以单质形式游离出来,应加入适量KI溶液,此反应的化学方程式为 。
(10分)为回收和利用废旧塑料减轻“白色污染”,某兴趣小组进行如下探究:
<实验课题>废旧聚丙烯塑料热分解主要产物为烃的探究
<查阅资料>
①废旧聚丙烯塑料热分解的产物为常温下的气态烃和液态烃,且不含一氧化碳和氢气
②CuO能将烃氧化成CO2和H2O
③甲苯可被酸性KMnO4溶液氧化为苯甲酸,苯甲酸能溶于苯
<实验设计>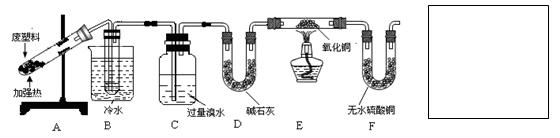
<实验记录>
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E中黑色氧化铜变红;④F中无水硫酸铜变蓝。
<问题讨论>
请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物。若要将两者分离,其实验方法是 ;若要除去混合物中的甲苯,其方法是向混合物中加入足量酸性KMnO4溶液,充分反应后,再加入一定量的NaOH溶液,充分反应,再 。
(2)C装置的作用是 ;如果没有D装置,对实验结论产生的影响是 。
(3)若需验证聚丙烯塑料热分解产物中确含气态烃,还需在F装置后增加一个实验装置,请将增加的装置图(要注明其中盛放的试剂名称)画在“实验设计”栏中的空白方框内。
已知:
Ⅰ.SO2通入碱溶液时:SO2+2OH-=SO32-+H2O ;SO2(过量)+OH-=HSO3-
Ⅱ.SO32-与H+反应生成SO2:① SO32-+H+= HSO3-;② HSO3-+H+ = SO2↑+H2O
(1)写出K2SO3与足量稀H2SO4反应制备SO2的离子方程式:
_________________________________________________________________。
(2)SO2与KOH溶液反应有多种可能,反应后溶液中溶质的组成可能是(填写化学式):
①K2SO3;②KHSO3;③______________ ;④ ;⑤ 。
(3)在数字实验中用传感器对亚硫酸钾和亚硫酸氢钾混合物样品进行测定,分别称取三份不同质量的混合物样品,配成溶液,然后用相同浓度的硫酸与之恰好反应,测得如下数据:
| 编号 |
1 |
2 |
3 |
| 混合物质量/g |
4.36 |
5.54 |
9.81 |
| 硫酸溶液体积/mL |
50.00 |
50.00 |
50.00 |
| 生成SO2的物质的量/mol |
0.03 |
0.0375 |
0.03 |
求:该混合物中K2SO3与KHSO3的物质的量之比是多少?写出计算过程。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号