25℃时,水的电离达到平衡:H2O H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
化学中常借助曲线图来表示某种变化过程,如平衡移动过程、中和滴定过程、沉淀的生成和溶解、④固体物质的溶解度变化过程等,下列曲线图中从左到右依次表示上述过程中的( )

| A.①②③④ | B.②③①④ | C.④③②① | D.②①③④ |
滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是_________________。
②上述滴定过程中操作滴定管的图示,正确的是____________。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH溶液浓度_________________(填“偏大”、“偏小”或“无影响”)。
(2)氧化还原滴定——用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,你认为合理的是___________________(填字母符号)。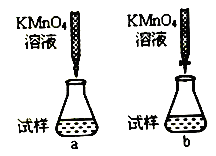
②判断滴定终点的依据是____________。
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如下图,则此时消耗标准溶液的体积为______________。
实验题
在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,请完成下面的测定实验分析报告。
(一)测定目的:测定××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(三)实验用品及试剂:仪器和用品(自选,略)
试剂:指示剂 ① (填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2)用 ② (填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的 ③ (填部位),右手摇动锥形瓶,眼睛注视 ④ ,直到滴定终点。滴定至终点时的现象是 ⑤ 。
(4)数据记录与处理:若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是 ⑥ mg/L。
(五)问题讨论:从分析数据看,此软包装橙汁是否是纯天然橙汁? ⑦ (填“是”或“不是”或“可能是”)。制造商最可能采取的做法是 ⑧ (填编号):
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
填空
(1)、甲溶液的pH是2,乙溶液的pH是4,求甲溶液和乙溶液的c(H+)之比为 。
(2)、电解饱和食盐水时,阴极析出气体是 (填化学式)。
(3)、现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是 。(结合离子反应方程式说明)
(4)、已知25℃时,醋酸和亚硫酸的电离平衡常数:醋酸K=1.75×10-5 ,亚硫酸K1=1.54×10-2、
K2=1.02×10-7。则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH H2SO3(填>、<或=)。
(5)、向明矾溶液中逐滴加入Ba(OH)2溶液,若加至铝离子刚好完全沉淀,请写出反应的离子反应方程式: 。
(6)、炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请写出铁锅腐蚀正极的电极反应式: 。
已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L NaHSO3和NaHCO3的两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是 ( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(H+)+c(H2RO3)=c(HRO3-)+c(OH-)
C.c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、 c(RO32-) 分别相等
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是 ( )
| A.①⑤ | B.③④ | C.②⑤ | D.②④ |
下列各选项所述的两个量中,前者一定大于后者的是 ( )
| A.用0.1 mol/L的盐酸中和pH、体积均相同的氨水和NaOH溶液消耗盐酸体积 |
| B.NH4Cl溶液中NH和Cl-的数目 |
| C.相同温度下,pH相同的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-) |
| D.纯水在100℃和25℃时pH |
将①H+、②NH4+、③NO3-、④K+、⑤CO32-、⑥OH-分别加入H2O中,基本上不影响水的电离平衡的是
| A.③④ | B.②③⑥ | C.①⑥ | D.②④ |
能使H2O  H++ OHˉ电离平衡向正反应方向移动,而且所得溶液显酸性的是
H++ OHˉ电离平衡向正反应方向移动,而且所得溶液显酸性的是
| A.将水加热到99℃,使水的pH=6.1 | B.在水中滴入稀H2SO4 |
| C.在水中加入Na2CO3固体 | D.在水中加入氯化铜固体 |
有下列盐:①FeCl3 ②CH3COONa ③NaCl,其水溶液的pH由大到小排列正确的是
| A.①>③>② | B.②>③>① | C.③>②>① | D.①>②>③ |
量取25.00mL硫酸溶液,可选用的仪器是
| A.50mL量筒 | B.25mL量筒 |
| C.50mL碱式滴定管 | D.50mL酸式滴定管 |
下列各种试纸,在使用时预先不能用蒸馏水润湿的是
| A.红色石蕊试纸 | B.蓝色石蕊试纸 | C.KI淀粉试纸 | D.pH试纸 |
在25℃时,将0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合后,测得混合溶液pH=8,则下列所表示的该混合溶液中有关微粒的浓度关系中,错误的是
A.c(HA)+c(A-)=c(Na+)=0.1 mol·L-1
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(Na+)>c(A-)>c(OH-)>c(H+)
D.c(OH-)=c(H+)+c(HA)