常温下用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是
| A.溶液中的c(CH3COO-) | B.溶液中的c(H+) |
| C.醋酸的电离平衡常数 | D.溶液中的c(OH-) |
下列说法正确的是
| A.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| B.0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) |
| C.浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3·H2O)+c(NH4+)=0.1mol/L |
| D.pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
I.下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t 1 |
t 2 |
| 水的离子积 KW |
1×10-14 |
1×10-13 |
1×10-12 |
试回答以下问题:
(1)25℃下,某 Na2SO4溶液中 c(SO42-)=5×10-4 mol∙L-1,取该溶液 1mL 加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=____________。
(2)在 t 2℃下,将 a mol∙L-1CH3COOH 溶液与 b mol∙L-1NaOH 溶液等体积混合反应后,溶液恰好呈中性,则该温度下 CH3COOH 的电离常数 Ka=____________(用 a、b 表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
Ag(NH3)2+(aq) △H =" a" kJ∙mol-1 K = c
②2Ag+(aq)+2OH-(aq)  Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
Ag2O(s)+H2O(l) △H =" b" kJ∙mol-1 K = d
(3)写出 Ag2O溶于氨水(用 NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________;
计算 25℃下,该反应的平衡常数(用 c、d 表示)K =____________________。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
| 离子 |
Mg2+ |
Cr3+ |
Cl- |
| 浓度(mol/L) |
0.5 |
0.01 |
a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的 a____________1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节 pH 的范围是_______________。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2∙6H2O)的操作是___________________。
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再进行测定。
(1)在高温下将 x克钢样中碳、硫转化为CO2、SO2(气体a)。
(2)将气体 a通入测硫装置中(如右图 1),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:____________________________________。
②将①的吸收液稀释至250mL,取1/10该溶液进行滴定,用酸式滴定管取液时赶走气泡的操作是_______________________。
③用c mol/L 标准NaOH溶液滴定取出的溶液,则选择的指示剂为____________,直至加入最后一滴 NaOH 溶液时,溶液颜色____________,即可停止滴定。
④某次滴定前后,NaOH在滴定前溶液的液面在0.30mL处,滴定结束时液面在溶液的液面如图2,其体积读数为____________________。若滴定3次,消耗NaOH溶液体积的平均值为 z mL,则该钢样中硫的质量分数为________________(用 x、c、z表示)。
⑤下列操作会造成测定结果偏高的是______________。
a.水洗后未用标准液润洗碱式滴定管 b.加入 1mL 酸碱指示剂
c.滴定终点时,尖嘴出现气泡 d.滴定终点俯视滴定管的刻度

将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
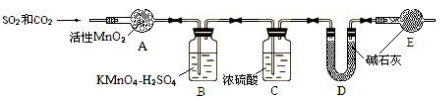
⑥为准确测定 CO2,需除去SO2的干扰,除去 SO2的装置是__________(填序号)。
⑦计算钢样中碳的质量分数,应测量的数据是________。去掉装置 E,测得碳的质量分数_________(填“偏小”、“无影响”或“偏大”)
⑧上述操作中,测定CO2前先除去SO2,但测定SO2前却没除CO2,是否合理?若不合理,说明如何改正;若合理,说明理由________________________。
下列实验能达到预期实验目的的是
| 实验 |
实验目的 |
| A.测定等物质的量浓度的CH3COONa和 Na2S溶液pH |
比较CH3COOH和H2S的酸性强弱 |
B. 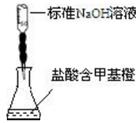 |
测定盐酸的浓度 |
C. 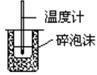 |
测定中和热 |
| D.先用酚酞,后用甲基橙作指示剂,用标准盐酸滴定0.1 mol/L的Na2CO3溶液 |
证明 CO32—水解分两步 |
常温下,若溶液中由水电离产生的 c(H+)=1×10-13 mol/L,满足此条件的溶液中,一定不能大量共存的离子组是( )
| A.K+、Na+、Cl-、HCO3- | B.Na+、Al3+、NO3-、SO42- |
| C.K+、Na+、Cl-、S2- | D.K+、NH4+、SO42-、NO3- |
有人曾建议用AG表示溶液的酸度,AG 的定义为: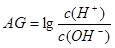 ,室温下实验室用0.01mol∙L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述正确的是
,室温下实验室用0.01mol∙L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述正确的是
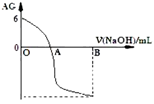
| A.A 点时加入氢氧化钠溶液体积为20 mL |
| B.OA 段溶液中:c(CH3COO-)> c(CH3COOH) |
| C.室温时 0.01 mol/L的醋酸溶液 pH=4 |
| D.若B点时加入NaOH溶液为40 mL,所得溶液中:c(CH3COO-)+ c(CH3COOH) = c(OH-) |
下列溶液均处于 25℃,有关叙述正确的是
| A.AgCl 在同浓度的CaCl2 和NaCl溶液中的溶解度相同 |
| B.0.1 mol∙L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中 c(H+) 是 pH=6.5 的牛奶中 c(H+)的 100 倍 |
已知 pOH值指溶液的碱度,以溶液中氢氧根离子浓度来表示,pOH=-lgc(OH-)。则下列溶液,一定呈中性的是
| A.c(H+)=1×10-7mol∙L-1的溶液 | B.pH=pOH 的溶液 |
| C.pH=14-pOH的溶液 | D.pOH=0的溶液 |
实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是( )
A.c(B+)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中溶液的颜色从_________色变为___________色时,停止滴定。
(2)下图中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是_________,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是___________(填“偏高”、“偏低”或“无影响”)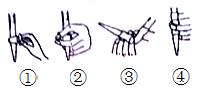
(3)图中是某次滴定时的滴定管中的液面,其读数为__________mL。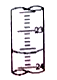
(4)根据下列数据:
| 滴定次数 |
待测液体积 |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.20 |
24.10 |
| 第二次 |
20.00 |
3.00 |
27.10 |
请计算待测烧碱溶液的浓度为____________mol/L。
将纯水加热至较高温度,下列叙述正确的是( )
| A.水的离子积变大,c(H+)变大,呈中性 |
| B.水的离子积不变,c(H+)不变,呈中性 |
| C.水的离子积变小,c(H+)变小,呈碱性 |
| D.水的离子积变大,c(H+)变大,呈酸性 |
室温下,某溶液由水电离出来的c(OH-)=10-13mol/L,则该溶液的溶质不可能是( )
| A.HCl | B.NaOH | C.H2SO4 | D.NH4NO3 |
某温度下,水的离子积Kw=1×10-13,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比是
| A.11﹕1 | B.9﹕1 | C.1﹕11 | D.1﹕9 |
(1)今有①CH3COOH ②HCl ③H2SO4三种溶液,当它们温度相同、pH相同时,其物质的量浓度由大到小排列的顺序是 (用序号表示)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为__________mol/L。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,请写出最先生成沉淀的离子方程式为 。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
(4)下列说法不正确的是 (填序号)。
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C.除去氯化钠溶液中的Mg2+,用NaOH溶液沉淀Mg2+比用Na2CO3溶液效果好,说明相同温度时Mg(OH)2的溶解度比MgCO3大 |
| D.沉淀反应中常加适当过量的沉淀剂,其目的是使相关离子沉淀完全 |