下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答: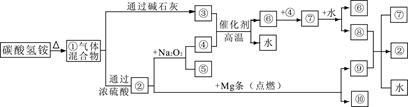
(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是 。
(2)写出碳酸氢铵中阳离子的检验方法 。
(3)写出工业上合成③的化学方程式 。
(4)⑧与⑨反应的化学方程式是 。
下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答:
(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是 。
(2)写出碳酸氢铵中阳离子的检验方法 。
(3)写出工业上合成③的化学方程式 。
(4)⑧与⑨反应的化学方程式是 。