(11分)现有反应:
A.CaCO3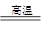 CaO+CO2↑ CaO+CO2↑ |
| B.Zn+H2SO4=ZnSO4+H2↑ |
C.C+CO2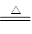 2CO 2CO |
| D.2KOH+H2SO4=K2SO4+2H2O |
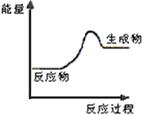
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合下图的是 (填反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是 (填反应序号),根据该原电池回答下列问题:
①负极材料是 ,负极发生 (填“氧化”或“还原”)反应;正极反应式为 。
②当导线中有1 mol电子通过时,理论上发生的变化是 (填序号)。 (相对原子质量:H1,Zn65)
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如下图所示。
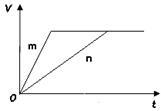
①m曲线表示锌与稀硫酸 (填“X”或“Y”)反应。
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是 (填序号)。
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO42-)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
 的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下。(所用石灰石含有杂质SiO2)
的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下。(所用石灰石含有杂质SiO2)
 ,相应的离子方程式为。
,相应的离子方程式为。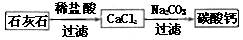
 2 FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);Cl2作氧化剂,具有性。在该反应中,若消耗了1 mol Fe,则转移_______mol 电子。
2 FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);Cl2作氧化剂,具有性。在该反应中,若消耗了1 mol Fe,则转移_______mol 电子。 粤公网安备 44130202000953号
粤公网安备 44130202000953号