已知:2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)ΔH=-1452kJ·mol-1
H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热ΔH=-571.6 kJ·mol-1 |
| B.H2SO4(aq)+Ba(OH)2(aq)= BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1 |
| C.同质量的H2(g)和CH3OH(l)完全燃烧生成液态水,H2(g)放出的热量多 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1 |
硫及其化合物在国民生产中占有重要的地位。
(1)常温常压下,已知1g 硫完全燃烧放出a kJ的热量,写出硫燃烧热的热化学方程式
。
(2)又已知2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-bkJ/mol,写出H2S完全燃烧生成二氧化硫和水的热化学方程式 。
下列说法不正确的是()
A.已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+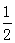 O2(g)=H2O(g),△H="-285.8" kJ/mol O2(g)=H2O(g),△H="-285.8" kJ/mol |
| B.中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C.稀氨水中部分粒子的浓度大小关系:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+) |
| D.1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
下列说法或表示方法正确的是()
| A.等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 |
| B.氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l) ∆H="-285.8" kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l) ∆H=-Q1 kJ/mol 2H2(g)+O2(g)=2H2O(g) ∆H=-Q2 kJ/mol,则Q1>Q2 |
| D.已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
(1)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化.回答下列问题:
①中学化学实验中的中和热的测定所需的玻璃仪器有:大烧杯、小烧杯、量筒、___________,在大小烧杯之间填满碎泡沫(或纸条)其作用是_____________________。
②该实验可用0.50mol•L-1HCl和0.55mol•L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是____________________.当室温低于10℃时进行,对实验结果会造成较大的误差其原因是_______________.
(2)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式分别为:CH4 (g)+2O2 (g)=CO2 (g)+2H2O(g);△H=-802.3 kJ/mol,
H2O(l)=H2O(g);△H=+44 kJ/mol;
则甲烷燃烧热的热化学方程式为_________________________。
已知甲醇的燃烧热数值为726.51kJ·mol-1。下列热化学方程式书写正确的是
| A.CH4O+3/2O2=CO2+2H2O △H=-726.51 kJ·mol-1 |
| B.CH4O(l)+ 3/2O2(g)=CO2(g)+2H2O(g) △H="+726.51" kJ·mol-1 |
| C.2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l) △H="+1453.12" kJ·mol-1 |
| D.CH4O(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.51 kJ·mol-1 |
大量使用会导致全球进一步变暖、雾霸天气增多的是下列能源中的
| A.化石能源 | B.太阳能 | C.氢能 | D.地热能 |
下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g)=2H2O(g) △H =-483.6kJ·mol-1,则氢气的标准燃烧热为-483.6kJ/mol |
| B.ΔH的数值与化学反应方程式的化学计量系数无关 |
| C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H =-57.4 kJ·mol-1 |
| D.己知C(s)+O2(g)=CO2(g) △H1;C(g)+O2(g)=CO2(g) △H2,则△H1﹤△H2 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
氢气是人类最理想的能源。已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,今有如下三个热化学方程式:
(1)H2(g)+ O2(g)=H2O(g) ΔH1=akJ/mol
O2(g)=H2O(g) ΔH1=akJ/mol
(2)2H2(g)+O2(g)=2H2O(l) ΔH2=bkJ/mol
(3)H2O(l)=H2(g)+ O2(g) ΔH3=ckJ/mol
O2(g) ΔH3=ckJ/mol
下列关于它们的表述正确的是
| A.2c=b | B.c=+285.8 |
| C.通过原电池可以实现反应(3) | D.氢气的燃烧热为a kJ/mol |
面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的主要方向。
(1) “生物质”是由植物或动物生命体衍生得到的物质的总和。生物质能主要是指用树木、庄稼、草类等植物直接或间接提供的能量.秸秆、杂草等废弃物经微生物发酵之后,便可以产生沼气,利用沼气是解决人类能源危机的重要途径之一。下面说法不正确的是( )
| A.利用生物质能就是间接利用太阳能,生物质能是可再生能源 |
| B.生物质能是解决农村能源的重要途径之一 |
| C.生物质能的缺点是严重污染环境 |
| D.若建立沼气发电站,则可以实现把生物质能转化为电能 |
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为 -890.3 KJ·mol-1、-285.8 KJ·mol-1、-283.0 KJ·mol-1,则该重整的热化学方式为 ;
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:
C(s) +CO2(g ) 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分 )=气体总压(P总 )×体积分数,则925℃时,用平衡分压代替平衡浓度表示的化学平衡常数= 。T℃时,若充入等体积的CO2和CO,平衡 (填“正向移动、逆向移动、不移动”)。
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分 )=气体总压(P总 )×体积分数,则925℃时,用平衡分压代替平衡浓度表示的化学平衡常数= 。T℃时,若充入等体积的CO2和CO,平衡 (填“正向移动、逆向移动、不移动”)。

(4)如下图是一个二甲醚(CH3OCH3)燃料电池工作时的示意图,
①若乙池为粗铜的电解精炼,电解质为硫酸铜,则N电极材料为 。
②若乙池中M、N为惰性电极,电解质为足量硝酸银溶液,写出乙池中电解的化学方程式 。乙池中某一电极析出金属银2.16g时,溶液的体积为200mL,则常温下乙池中溶液的pH为 。
③通入二甲醚的铂电极的电极反应式为 。若该电池的理论输出电压为1.0V,则该电池的能量密度= kW·h·kg-1(结果保留小数点后一位).(能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J,法拉第常数F=9.65×l04C·mol-1 )。
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH<0。
(1)在25℃、101 kPa下,1 g甲醇(液态)完全燃烧后,恢复到原状态放热Q kJ,则表示甲醇燃烧热的热化学方程式为 。
(2)工业上利用甲醇制备氢气常用的方法之一是甲醇蒸气重整法。此方法当中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),说明该反应能自发进行的原因 。
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。
①通入气体a的电极是电池的______________(填“正”或“负”)极,其电极反应式为_______________;
②当电池中有2 mole-发生转移时,左右两侧溶液的质量之差为__________________(忽略气体的溶解,假设反应物完全耗尽)。