常温下将NaOH溶液添加到己二酸( )溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
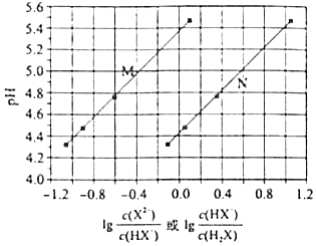
| A. |
的数量级为 |
| B. |
曲线N表示pH与 的变化关系 |
| C. |
NaHX溶液中 |
| D. |
当混合溶液呈中性时, |
298K时,在 氨水中滴入 的盐酸,溶液的 与所加盐酸的体积关系如图所示。已知 氨水的电离度为 ,下列有关叙述正确的是

| A. |
该滴定过程应该选择酚酞作为指示剂 |
| B. |
点对应的盐酸体积为 |
| C. |
点处的溶液中 |
| D. |
点处的溶液中 |
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3 )和BaS制备高纯MnCO3的工艺流程如图:
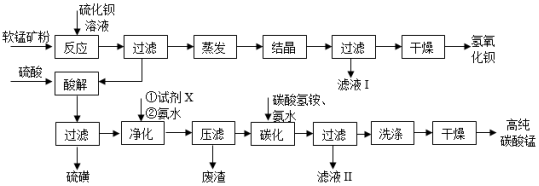
已知:MnO2是一种两性氧化物; 25℃时相关物质的Ksp见下表。
|
物质 |
Fe(OH)2 |
Fe(OH)3 |
Al(OH)3 |
Mn(OH)2 |
|
Ksp |
1×10﹣16.3 |
1×10﹣38.6 |
1×10﹣32.3 |
1×10﹣12.7 |
回答下列问题:
(1)软锰矿预先粉碎的目的是 ,MnO2 与BaS溶液反应转化为MnO的化学方程式为 。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是 。
(3)滤液Ⅰ可循环使用,应当将其导入到 操作中 (填操作单元的名称)。
(4)净化时需先加入的试剂X为 (填化学式),再使用氨水调溶液的pH,则pH的理论最小值为 (当溶液中某离子浓度c≤1.0×10﹣5mol•L﹣1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为 。