凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知: .
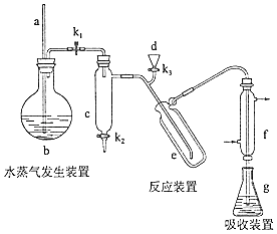
回答下列问题:
(1)a的作用是________.
(2)b中放入少量碎瓷片的目的是________.f的名称是________.
(3)清洗仪器:g中加蒸馏水:打开 , 关闭 、 , 加热b,蒸气充满管路:停止加热,关闭 , g中蒸馏水倒吸进入c,原因是________;打开 放掉水,重复操作2~3次.
(4)仪器清洗后,g中加入硼酸( )和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 , d中保留少量水,打开 , 加热b,使水蒸气进入e.
①d中保留少量水的目的是________.
②e中主要反应的离子方程式为________,e采用中空双层玻璃瓶的作用是________.
(5)取某甘氨酸( )样品m 克进行测定,滴定g中吸收液时消耗浓度为 的盐酸 ,则样品中氮的质量分数为________%,样品的纯度≤________%.
宋代《千里江山图)描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分
为Cu(OH)2•CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2•2CuCO3)。下列说法错误的是( )
A.保存《千里江山图》需控制温度和湿度
B.孔雀石、蓝铜矿颜料不易被空气氧化
C.孔雀石、蓝铜矿颜料耐酸耐碱
D.Cu(OH)2•CuCO3中铜的质量分数高于Cu(OH)2•2CuCO3
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
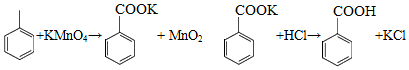
|
名称 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
密度/(g•mL﹣1) |
溶解性 |
|
甲苯 |
92 |
﹣95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
|
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
﹣﹣ |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g (约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol•L﹣1的KOH标准溶液滴定,三次滴定平均消耗21.50mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
A.100mL B.250mL C.500mL D.1000mL
(2)在反应装置中应选用 冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ; 据此估算本实验中苯甲酸的产率最接近于 (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。
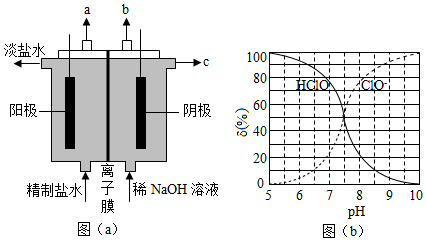
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X) ,X为HClO或ClO ﹣]与pH的关系如图(b)所示。HClO的电离常数K a值为 。
(3)Cl 2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl 2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl 2O的化学方程式为 。
(4)ClO 2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO 2、NaHSO 4、NaHCO 3的"二氧化氯泡腾片",能快速溶于水,溢出大量气泡,得到ClO 2溶液。上述过程中,生成ClO 2的反应属于歧化反应,每生成1mol ClO 2消耗NaClO 2的量为 mol;产生"气泡"的化学方程式为 。
(5)"84消毒液"的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的离子方程式为 ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是 。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%.通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
C3N3O3Cl2﹣+H++2H2O═C3H3N3O3+2HClO
HClO+2I﹣+H+═I2+Cl﹣+H2O I2+2S2O32﹣═S4O62﹣+2I﹣
准确称取1.1200g样品,用容量瓶配成250.0mL溶液:取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol•L﹣1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品。
(写出计算过程,该样品的有效氯 100% )
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值 ( 填“偏高”或“偏低”)。