阿伏加德罗常数的值为 。下列说法正确的是( )
| A. |
溶液中, 的数量为 |
| B. |
与 完全反应,转移的电子数为 |
| C. |
标准状况下, 和 的混合气体中分子数为 |
| D. |
和 于密闭容器中充分反应后,其分子总数为 |
已知
是阿伏加德罗常数的值,下列说法错误的是( )
| A. |
含有的中子数为 |
| B. |
磷酸钠溶液含有的 数目为 |
| C. |
被还原为 转移的电子数为 |
| D. |
48g正丁烷和10g异丁烷的混合物中共价键数目为 |
双氧水是一种重要的氧化剂、漂白剂和消毒剂.生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
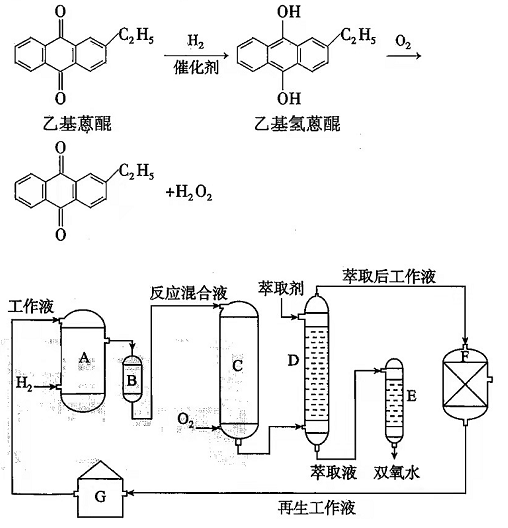
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水.回答下列问题:
(1)蒽醌法制备H 2O 2理论上消耗的原料是________,循环使用的原料是________,配制工作液时采用有机溶剂而不采用水的原因是________.
(2)氢化物A中反应的化学方程式为________.进入氧化塔C的反应混合液中的主要溶质为________.
(3)萃取塔D中的萃取剂是________,选择其作萃取剂的原因是________.
(4)工作液再生装置F中要除净残留的H 2O 2, 原因是________.
(5)双氧水浓度可在酸性条件下用KMnO 4溶液测定,该反应的离子方程式为________,一种双氧水的质量分数为27.5%(密度为1.10g•cm ﹣ 3),其浓度为________mol•L ﹣ 1.
以硅藻土为载体的五氧化二钒( )是接触法生产硫酸的催化剂.从废钒催化剂中回收 既避免污染环境又有利于资源综合利用.废钒催化剂的主要成分为:
|
物质 |
|
|
|
|
|
|
|
质量分数/% |
2.2~2.9 |
2.8~3.1 |
22~28 |
60~65 |
1~2 |
<1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)"酸浸"时 转化为 , 反应的离子方程式为________,同时 转成 . "废渣1"的主要成分是________.
(2)"氧化"中欲使 的 变为 , 则需要氧化剂 至少为________mol.
(3)"中和"作用之一是使钒以 形式存在于溶液中."废渣2"中含有________.
(4)"离子交换"和"洗脱"可简单表示为: (以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈________性(填"酸""碱""中").
(5)"流出液"中阳离子最多的是________.
(6)"沉钒"得到偏钒酸铵( )沉淀,写出"煅烧"中发生反应的化学方程式________.
元素铬(Cr)在溶液中主要以 (蓝紫色)、 (绿色)、 (橙红色)、 (黄色)等形式存在, 为难溶于水的灰蓝色固体, 回答下列问题:
(1) 与 的化学性质相似,在 溶液中逐滴加入 溶液直至过量, 可观察到的现象是 。
(2) 和 在溶液中可相互转化。室温下,初始浓度为 的 溶液中 随 的变化如图所示。

①用离子方程式表示 溶液中的转化反应____________。
②由图可知,溶液酸性增大, 的平衡转化率__________(填"增大"减小"或"不变")。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中 的平衡转化率减小,则该反应的 _________(填"大于""小于"或"等于")。
(3)在化学分析中采用 为指示剂,以 标准溶液滴定溶液中的Cl −,利用Ag +与 生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好完全沉淀(浓度等于 )时,溶液中 为_______ ,此时溶液中 等于__________ 。(已知 、 的 分别为 和 )。
(4)+6价铬的化合物毒性较大,常用 将废液中的 还原成 ,反应的离子方程式为______________。
为阿伏加德罗常数的值,下列叙述正确的是( )
| A. |
重水( )中含有的质子数为 |
| B. |
的 与 完全反应时转移的电子数为 |
| C. |
环状
( |
| D. |
的 溶液中 离子数为 |
NA是阿伏加德罗常数的值。下列说法正确的是( )
A.22.4L(标准状况)氮气中含有7NA个中子
B.1mol重水比1mol水多NA个质子
C.12g石墨烯和12g金刚石均含有NA个碳原子
D.1L 1mol•L﹣1NaCl溶液含有28NA个电子
以黄铁矿(主要成分FeS 2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如图所示。

回答下列问题:
(1)黄铁矿中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为 。
(3)欲得到更纯的NaHSO 3,反应①应通入 (填"过量"或"不足量")的SO 2气体。
(4)因为Na 2S 2O 5具有 性,导致商品Na 2S 2O 5中不可避免地存在Na 2SO 4。检验其中含有SO 4 2 ﹣的方法是 。
(5)一般用 K 2Cr 2O 7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K 2Cr 2O 7溶液滴定其中的Fe 2+。
反应式:Cr 2O 7 2 ﹣+6Fe 2++14H +═2Cr 3++6Fe 3++7H 2O
某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol•L ﹣ 1的K 2Cr 2O 7溶液25.10mL,则样品中铁含量为 %。