宏观和微观相联系是化学独特的思维方式。
(1)微观探析化学反应的规律是化学科学的核心任务。根据下列微观示意图回答问题:

①从微粒的角度说明图A反应的实质是 ;
②图B所示反应中,参加反应的微粒是 (写出微粒的符号)。
(2)化学上有一种能将微观粒子数目与宏观物质质量联系起来的量,叫物质的量,其单位是摩尔。1摩尔任何物质中含有构成它的微粒个数都是6.02×10 23个,1摩尔任何物质的质量是以克为单位,数值上都等于该物质的化学式量。例如1摩尔水的各种量关系如图:

①1摩尔水中氢原子数目是 个;②1摩尔水中氧元素质量为 g。
如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用图中表示的序号表示配制溶液的正确操作顺序 .
(2)图②中,有一种塑料仪器,其名称是 .
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图⑥,则称取的NaCl质量为 .
(4)根据计算需要量取水的体积是 (水的密度为1g/mL).
(5)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数 (填“大于”、“小于”或“等于”)10%.
向100克溶质质量分数为20%的硝酸钾溶液中加入100克水,所得溶液中溶质质量分数是()
| A.5% | B.10% | C.20% | D.40% |
水是生命的源泉,下列变化与水相关。请回答:
①二氧化碳溶于水发生反应的化学方程式是(1) 。
②自来水厂净水过程中常用到活性炭,其作用是(2) 。
③铁丝在氧气中燃烧时,集气瓶内放少量水的目的是(3) 。
④除去粗盐中泥沙等难溶性杂质的实验步骤:
I. 操作a的名称是(4) ;
II. 三个步骤都用到的玻璃仪器是(5) 。
⑤甲和乙两种固体物质(不含结晶水)的溶解度曲线如下图所示,回答下列问题: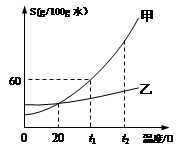
I.在 (6) ℃时,甲和乙两种物质的溶解度相等。
II.t1℃时,将50g固体甲加到50g水中,充分搅拌后所得溶液的质量为 (7) g。
III.甲的饱和溶液中含有少量的乙,由该液体得到固体甲采用的方法是(8) 。
IV.若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是(9) 。
A.溶剂的质量一定变小B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量变大
⑥下图是对20℃一定质量的丙溶液进行恒温蒸发结晶的实验过程,请回答: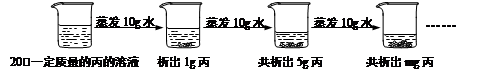
I.蒸发前原溶液是 (10) (填“饱和”或“不饱和”)溶液;m的数值是 (11) 。
II.依据上述实验,你认为丙的溶解度随温度变化的趋势是 (12) (填字母)。
A.随温度升高而增大 B.随温度升高而减小 C.无法判断
如图是甲、乙、丙三种固体物质的溶解度曲线。
① P点的含义 。
② 要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 (写出一种)。当甲溶液中含有少量乙时,可采用 的方法提纯甲。
③ t2℃时,将30 g甲物质放入50 g水的烧杯中,所得溶液溶质的质量分数为 (精确到0.1)。若烧杯内物质升温到t3℃(不考虑水蒸发),溶液中变化的是 。
Ⅰ.溶质的质量 Ⅱ.溶剂的质量 Ⅲ.溶质的质量分数
④ t2℃时,在含有50 g水的甲和乙的饱和溶液中,分别加入m g甲和m g乙,升温至t3℃,甲完全溶解,乙仍有剩余,则m的质量范围是 。
t℃时,在饱和硫酸铜溶液中加入a g无水硫酸铜,恢复至原温度可析出b g硫酸铜晶体。说法正确的是
| A.溶液中溶剂的量不变,颜色不变 |
| B.b g硫酸铜晶体中含硫酸铜的质量大于a g |
| C.溶质质量分数不变,溶解度变小 |
| D.(b-a)g表示原溶液损失的溶质质量 |
如图是甲、乙两种物质的溶解度曲线,请结合图回答问题: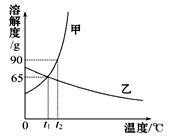
(1) ℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是 (填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是 。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数 乙溶液的溶质质量分数。(填“大于”“等于”或“小于”)。
(5)小明同学用甲物质进行以下实验: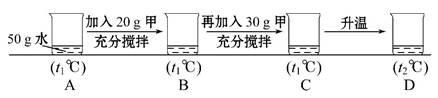
①实验过程中,B、C、D对应的溶液为不饱和溶液的是 。
②向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是 。
泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液的溶质质量分数偏小的是
①称量好的食盐倒入烧杯时,有少许洒出 ②量水的体积时,俯视量筒
③溶解食盐的烧杯内壁是潮湿的 ④用4g食盐和100g水配制溶液.
| A.②③ | B.①③④ | C.①②③ | D.①②③④ |
如图表示M、N两种物质的饱和溶液的溶质质量分数随温度变化的曲线。现分别向50克M、80克N固体中各加入150克水,并加热至完全溶解,同时各蒸发掉50克水,冷却至t℃,下列分析正确的是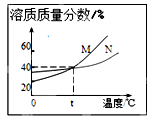
| A.M、N两溶液的溶质质量分数相等 |
| B.只有N析出晶体 |
| C.M、N均有晶体析出 |
| D.M、N两溶液都是饱和溶液。 |
下列有关溶液的认识中,错误的是
| A.析出晶体后的溶液是该温度下的饱和溶液 |
| B.在溶液里进行的化学反应,通常是比较快的 |
| C.同种溶质的饱和溶液,一定比它的不饱和溶液的浓度大 |
| D.食物里的营养成分经消化变成溶液,容易被人体吸收 |
如右图所示,20℃时100g硫酸铜饱和溶液中,分别加入下列物质后,相关分析错误的是
| A.溶质质量:Ⅰ=Ⅲ>Ⅱ | B.溶剂质量:Ⅰ>Ⅲ>Ⅱ |
| C.溶液质量:Ⅰ>Ⅱ=Ⅲ | D.溶质质量分数:Ⅰ<Ⅱ=Ⅲ |
某化学兴趣小组进行了“配制100g20%的氯化钠溶液”的实验。该实验的部分操作如下图所示。
(1)配制此氯化钠溶液的步骤为 、 、溶解。配制过程中用到的仪器有 、 、天平、量筒、药匙和胶头滴管。
(2)需要称取氯化钠的质量是_________g,称量时操作A出现了右盘低的现象,接下来的操作应该是________。(填序号)
① 右边的平衡螺丝向左调②右边的平衡螺丝向右调③右盘中减少砝码④左盘中增加食盐
(3)B中仪器a的名称是_________。量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数_______________(填“偏大”或“偏小”)
(4)C中用玻璃棒的作用是________________________。
将200g溶质质量分数为10%的蔗糖溶液,蒸发水变成溶质质量分数为20%的蔗糖溶液,需蒸发水的质量为
| A.90g | B.150g | C.100g | D.80g |
对“10%的食盐水”含义解释不合理的是
| A.100g食盐水中溶解了10g氯化钠 |
| B.将氯化钠与水按10:90的质量比配成的溶液 |
| C.100g水中溶解了10g氯化钠 |
| D.将20g氯化钠溶解在180g水中所得的溶液 |