已知20℃时CuSO4的溶解度为32g。20℃时,取一定质量某CuSO4溶液于烧杯中,按如图进行实验(整个过程中忽略溶剂损失),下列说法不正确的是( )
A.溶液中溶质质量分数的大小关系为丁>丙>甲
B.丙中溶液溶质与溶剂的质量比为8:25
C.丁溶液一定是饱和溶液
D.CuSO4 50℃时的溶解度比20℃时的大
甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

如图是甲和乙两种物质(不含结晶水)的溶解度曲线。下列说法正确的是( )

A.图中阴影部分表示的甲和乙两溶液都是饱和溶液
B.t1℃时,等质量甲和乙的饱和溶液中溶质质量相等
C.t2℃时,甲饱和溶液的溶质质量分数为60%
D.将t2℃时乙的饱和溶液降温至t1℃,变为不饱和溶液
NaOH、KNO3和Na2CO3在不同温度下的溶解度如下表所示。
|
温室/℃ 溶解度/g 物质 |
0 |
10 |
20 |
30 |
40 |
|
NaOH |
42.0 |
51.0 |
109.0 |
119.0 |
129.0 |
|
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
|
Na2CO3 |
6.0 |
16.0 |
18.0 |
36.5 |
50.0 |
下列实验过程中不考虑化学变化、水的蒸发和结晶水合物等因素。
(1)10℃时,KNO3的溶解度 (填“>”、“<”或“=”)Na2CO3的溶解度。
(2)40℃时,将129g NaOH固体加入到100g水中,搅拌后固体全部消失,放置到t1时刻开始析出固体,到t2时刻析出10g固体。
①t1时刻为 (填“饱和”或“不饱和”)溶液。
②t2时刻溶液的温度为 ℃。
(3)40℃时,将等质量的三种物质的饱和溶液冷却到30℃,所得溶液中溶剂质量最多的是 (填序号)。
A.Na2CO3溶液
B.KNO3溶液
C.NaOH溶液
科学发现往往源于对实验现象的观察与研究。
(1)如图甲进行白糖溶解实验,根据图中现象判断:溶液② (填“是”“不是”或“可能是”)白糖的饱和溶液。

(2)如图乙所示,小科利用集气瓶收集从导管导出的氧气时,每隔一段时间,他就取出导管,再用带火星的木条放在瓶口验满。可是他始终没有观察到带火星木条复燃,小科实验操作中出现的错误是 。
如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线。下列说法错误的是( )

| A. |
甲物质的溶解度受温度变化影响较大 |
| B. |
t 1℃时甲、乙两物质的溶解度相等 |
| C. |
乙物质中混有少量的甲,可用冷却热饱和溶液的方法提纯乙 |
| D. |
t 2℃时向100g水中加入70g甲物质充分搅拌后,所得的溶液是甲物质的饱和溶液 |
如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO 3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH 4NO 3固体后,甲中未观察到明显现象。下列说法正确的是( )

| A. |
乙中溶液一定变浑浊 |
| B. |
甲中溶液一定变成饱和溶液 |
| C. |
乙中溶液溶质的质量分数一定变小 |
| D. |
甲、乙中溶液质量一定相等 |
某小组同学在探究过程中,通过观察与实验,推理与判断,如不考虑水分蒸发,最后得出的结论正确的是( )

|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
|
溶解度/g |
熟石灰 |
0.18 |
0.16 |
0.14 |
0.11 |
0.09 |
|
硫酸铜晶体 |
14.3 |
20.7 |
28.5 |
40 |
55 |
|
| A. |
①中溶液的溶质质量分数为16% |
| B. |
②中加入氢氧化钠的过程中,有氢氧化钙析出 |
| C. |
③中棉线上析出晶体的质量一定是34.3g |
| D. |
④中加入氢氧化钠前、后均为硫酸铜饱和溶液 |
下列有关水与溶液的说法错误的是( )
| A. |
电解水时,负极产生的是氢气 |
| B. |
溶液是均一、稳定的混合物 |
| C. |
饱和溶液就是不能再溶解任何物质的溶液 |
| D. |
天然淡水生产自来水需要经过沉降、过滤、杀菌消毒等净化过程 |
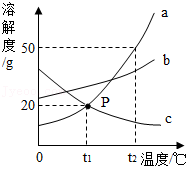
如图是a、b、c三种物质的溶解度曲线,回答下列问题。
(1)P点的含义是 。
(2)t2℃时,将60g a物质加入到100g水中,充分溶解后,所得溶液中溶质与溶液的质量比是 。
(3)t2℃时,要使接近饱和的c溶液变为饱和溶液,采用的方法是 。
(4)t2℃时,等质量的a、b、c三种物质的饱和溶液中溶质的质量分数由大到小的顺序为 。
为探究硝酸钾的溶解性,进行了如图实验(见图Ⅰ),结合KNO3溶解度曲线(见图Ⅱ)判断,下列说法错误的是( )

A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.溶液②、溶液③的质量:③>②
D.溶液②、溶液③、溶液④的溶质质量分数:③>②=④
两种固体物质NaCl和KCl的溶解度曲线如图1所示。现有40g NaCl、40g KCl两份固体,分别置于两只烧杯中,各倒入100g 50℃蒸馏水充分溶解,实验现象如图2所示。下列推断正确的是( )

A.甲中加入的固体是NaCl
B.乙中溶液的质量是140g
C.50℃时,甲中溶液恰好达到饱和状态
D.分别将甲、乙中的溶液降温至10℃,乙中溶质的质量分数大于甲中溶质的质量分数
根据NaCl和KNO3的溶解度数据表,回答下列问题:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
|
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
|
(1)10℃时,NaCl的溶解度是 g;
(2)30℃时,溶解度较大的是 (选填“NaCl”或“KNO3”);
(3)下列分析正确的是 。
A.10℃时,能够配制出溶质的质量分数为20.9%的KNO3溶液
B.20℃时,20g NaCl固体加入100g水,充分溶解后得到NaCl的不饱和溶液
C.20℃到30℃之间,能配制出溶质质量分数相等的NaCl饱和溶液和KNO3饱和溶液
D.将KNO3溶液经过某种操作后,析出KNO3晶体,过滤后所得溶液溶质的质量分数与原溶液相比,可能变大、变小或不变
甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法正确的是( )

| A. |
10℃时,甲的溶解度最大 |
| B. |
图中P点表示10℃时丙的饱和溶液 |
| C. |
20℃时,向130g乙的饱和溶液中加入20g水,乙的质量分数变为20% |
| D. |
50℃时,同质量的甲、乙、丙饱和溶液降温至10℃,丙溶液中析出固体最多 |
氯化钠是生产、生活中的一种重要化合物,应用很广泛。
Ⅰ.图甲和图乙分别是钠原子和氯原子的原子结构示意图。

(1)图甲中的x= 。
(2)金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的1个电子,从而形成最外层有 个电子的相对稳定的氯离子,氯离子用化学符号表示为 。
Ⅱ.如表是氯化钠在不同温度下的溶解度数据。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
(1)30℃时,将10g氯化钠加入到50g水中,充分搅拌后,所得到的氯化钠溶液属于
(填“饱和”或“不饱和”)溶液。
(2)医用盐水(溶质为NaCl)的溶质质量分数为0.9%,现有200mL该盐水(假定该溶液的密度为1g/mL),其中含NaCl的质量为 g。
(3)学生化学实验活动之一:配制50g质量分数为6%的氯化钠溶液,该实验需要的仪器有药匙、托盘天平、玻璃棒、胶头滴管、 (从下列图中选择写出名称)。

Ⅲ.工业上常用电解饱和食盐水的方法来制取氢氧化钠、氯气和氢气,其化学反应方程式可表示为:xNaCl+yH2O zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
(填数字)。