(10揭阳)21.某实验小组对实验室中A、B、C、D四瓶无色溶液进行鉴别,它们分别是硫酸钠、稀硫酸、澄清石灰水、四种物质的一种。可供使用的实验用品有:稀盐酸、稀硫酸、碳酸钠、紫色石蕊溶液、硝酸钡溶液、硝酸银溶液、稀硝酸溶液、玻璃棒、试管、胶头滴管。请利用提供的实验用品,鉴别出四种物质,并完成实验报告:
| 实验 |
实验操作 |
实验现象 |
实验结论 |
| ① |
取四支试管,各取少量的A、B、C、D溶液,分别先滴加紫色石蕊试液 |
B溶液变红色,D溶液变成蓝色。A、C溶液都呈 色。 |
B是 D是 |
| ② |
另取二支试管,各取少量的A、C溶液,分别先滴入硝酸钡溶液后再滴入稀硝酸溶液。 |
|
A是硫酸钠溶液 C是 |
【发现问题】做完实验②后,该小组在网上查阅资料的时候发现,用稀硝酸酸化的硝酸钡溶液进行检验SO42-时,亚硫酸根离子(SO32-)的存在干扰了SO42-的检验。如往亚硫酸钠(Na2SO3 )溶液滴加硝酸钡溶液后有沉淀生成,再加足量的稀硝酸酸依然有白色沉淀。
【提出问题】若某无色溶液中可能含有硫酸根离子(SO42-)与亚硫酸根离子(SO32-)中的一种或两种,该如何检验?
【查阅资料】亚硫酸钡(Ba2SO3)是无色晶体或白色粉末,微溶于水,在水中是白色沉淀。中性或碱性条件下NO3-不能和SO32-反应,但在酸性条件下,NO3-能和H+反应相遇时(HNO3)具有强氧化性,易把SO32-氧化生成SO42-。往亚硫酸钡中加入盐酸能发生类似于碳酸钡与盐酸的反应,生成有刺激性的气体。
【猜 想】该无色溶液中含有(1)SO42- (2)SO32- (3) 。
【实验探究】请你将下列实验填写完整。
| 实验 |
实验操作 |
实验现象 |
实验结论 |
| ③ |
取该溶液少量试管E中,加入硝酸钡溶液后再加入稀硝酸酸 |
有白色沉淀生成 |
不能确定猜想 一定成立 |
| ④ |
取该溶液少量试管F中,加入加入稀盐酸,加热 |
有刺激性气味的气体生成 |
猜想 可能成立 |
| ⑤ |
在④所得的溶液中加入足量的 |
|
猜想(3)成立 |
写出亚硫酸钠溶液与硝酸钡溶液发生复分解反应的化学方程式: 。
【得出结论】要鉴别一种离子的存在,必须排除其它离子的干扰,不然会得出错误的结论
亚硝酸钠(NaNO2)是一种外观极像食盐,且具有与食盐一样咸味的有毒物质,因此,这种工业盐常被冒充食盐掺假或被误作食盐使用,导致多起中毒事故发生。某校化学实验室有一瓶标签破损的试剂瓶,盛放的药品可能是氯化钠固体,也可能是亚硝酸钠固体,该校化学小组同学通过实验手段确定该瓶盛放的药品的成分。
其主要探究过程如下:
【提出假设】该药品的成分是NaCl。
【查阅资料】
| |
亚硝酸钠 |
氯化钠 |
| 溶解性 |
15℃时溶解度为81.5g |
15℃时溶解度为35.8g |
| 熔点 |
271℃ |
801℃ |
| 沸点 |
320℃时发生分解有氧气等气体产生 |
1413℃ |
【实验过程】化学小组同学根据自己的假设,设计实验验证。请你帮助他们完成实验报告。
(1)小华同学设计的实验如下:
| 实验装置 |
实验主要过程 |
 |
①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到 ,松开手后,导管口有液面上升。 ②加入药品,加热,导管口有大量气泡生成。 ③收集气体。 ④停止加热。熄灭酒精灯前,应 ,目的是 。 |
(2)小明同学根据小华的实验判断该药品的成分是 。他又结合两物质的溶解性知识,设计了另一种实验方案,得到了同样的结论。其实验方案是 。
我们常用实验探究的方法来研究常见物质的组成,如下图:
A.实验是利用可燃物消耗瓶内的 64 ,使瓶内压强减少来推测空气里氧气的含量;
B.实验是通过电解水生成氧气和 65 ,可以说明水是由 66 组成的;
C.实验原理与 67 (填实验代号)实验相同。
甲同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬的。她想到在学过的金属活 动性顺序中并没有金属铬,为比较铬与常见金属铁、铜的活动性强弱,她和同学们在应用所学知识进行分析的基础上,提出了以下猜想,并进行了实验探究。
动性顺序中并没有金属铬,为比较铬与常见金属铁、铜的活动性强弱,她和同学们在应用所学知识进行分析的基础上,提出了以下猜想,并进行了实验探究。
【作出猜想】
猜想1. Cr>Fe>Cu;  猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】
①铬(Cr)是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【实验药品】
铁片、铬片、铜片、稀硫酸、CuSO4溶液、CrSO4溶液、FeSO4溶液。(溶液均为新制)
【甲同学实验】甲同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的稀硫酸。
| 实验 |
实验操作 |
实验现象 |
结论与解释 |
| 试管1 |
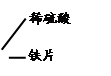  |
铁片表面产生气泡较慢,溶液变为浅绿色。 |
(1)实验前用砂纸打磨金属片的目的是 。 (2)甲同学得到的结论是猜想 正确。 |
| 试管2 |
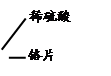  |
铬片表面产生气泡较快,溶液变为蓝色。 |
|
| 试管3 |
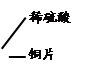  |
。 |
【乙同学实验】乙同学为验证甲同学的结论,又设计了以下实验。
| 实验 |
实验操作 |
实验现象 |
结论与解释 |
| 试管4 |
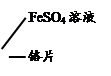  |
|
(1)甲同学的结论正确。 (2)请写出铬与硫酸铜反应的化学方程式 。 |
| 试管5 |
  |
【实验反思】
(1)你认为乙同学没有必要做的实验是 。
(2)请你结合所给的实验药品再设计一个实验,验证甲同学的结论。
| 实验操作和实验现象 |
结论与解释 |
| 。 |
甲同学的结论正确。 |
汽车已成为许多人出行的主要交通工具,行车安全已越来越受到人们的重视。汽车安装安全气囊可以有效保护乘车人员,在车辆发生碰撞的瞬间,安全装置通电点火,使其中的粉末迅速分解释放出大量的氮气,形成气囊,该粉末由Fe2O3固体和化合物甲组成,加热13.0克化合物甲,完全分解生成8.4克氮气和单质乙.单质乙可在高温隔绝空气的条件下与Fe2O3发生置换反应,有Na2O生成。
(1)化合物甲的化学式是 ;
(2)Na2O可与空气中的两种氧化物通过化合反应转化为碳酸氢钠(NaHCO3),则反应的化学方程式为
用木炭还原氧化铜的实验如图所示。
(1)酒精灯加网罩的目的是 ;
(2)刚开始预热,试管②中立即产生气泡,但石灰水
不变浑浊,原因是 ;
(3)继续加热,观察到试管①中的现是 ;
(4)请写出试管①中发生反应的化学方程式是: 。
实验室利用下列装置可以制取某些气体,请据图回答问题: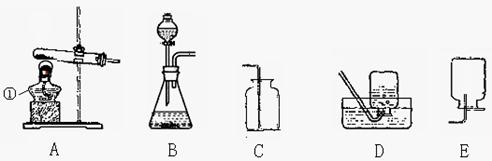
(1)这五个装置示意图中,有一个装置是错误的,指出错误装置是 (填序号)。
(2)图示中仪器①的作用 ;实验室用高锰酸钾来制取氧气,可选择A作发生装置,但要对A进行改进,改进的方法是 ;实验室若用B作发生装置制氧气,则该反应方程式为 。
(3)常温下,硫化氢(H2S)是一种有臭鸡蛋气味的气体,实验室可用硫化亚铁(FeS)固体和稀硫酸反应制得,该反应方程式为FeS + H2SO4(稀)= H2S↑+Fe SO4,则应选择
(填序号,下同)来作发生装置。
(4)NO气体难溶于水,密度略大于空气,易与氧气反应生成NO2,则应选择 装置来收集NO。
同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
(1)填表
| 实验步骤 |
观察到的现象 |
| ①在试管中取少量盐酸,插入铁丝,充分作用。 |
|
| ②在①所得的溶液中,插入 ,充分作用。 |
无明显现象 |
| ③在②所得的溶液中插入 ,充分作用。 |
|
结论:金属活动性Al > Fe > Cu
小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al>Fe>H>Cu的结论。小华要补充的实验是 ;
小明和小艳在实验室配制石灰水时,小明同学将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是他认为熟
石灰样品已经变质。小艳同学不同意他的判断,你认为小艳同学的理由是
。针对该熟石灰样品的成分同学们展开了讨论,请你参与讨论并完成实验报告。
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3;
你认为是 。
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤。 向滤液中加入适量 溶液; 向滤出固体中加入适量 溶液。 |
; 。 |
猜想正确 |
【拓展与应用】小组同学反思了熟石灰变质的原因,认识到实验室应 保存熟石灰。
(9分) 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
⑴写出试管②中碳酸钠与氢氧化钙反应的化学方程式:
。
⑵实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】 小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是 (写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由。
【实验设计】设计一个简单的实验证明你的猜想正确。
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中, |
|
你的猜想正确 |
【实验分析】小亮同学针对自己的猜想进行了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中,滴入几滴稀盐酸 |
没有气泡产生 |
自己的猜想不成立 |
你认为小亮同学对实验结果判断是否正确?请说明理由。
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑
;
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水
道? 。
同学们在学习碱的化学性质时,进行了如图8所示的实验。
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】 废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和 (写物质名称) 。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有
如下猜想。
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是 。(写一种猜想)
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
| 实验内容 |
预计现象 |
预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 |
①有白色沉淀,溶液呈红色。 |
的猜想正确。 |
| ② 。 |
的猜想正确。 |
|
| ③ 。 |
的猜想正确。 |
【反思拓展】 在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑
。
某化学兴趣小组进行溶液的配制和粗盐的初步提纯实验。
(1)配制200g质量分数为8%的氢氧化钠溶液:
①计算:需要氢氧化钠固体的质量为 克,需要水的体积为 mL(水的密度近似看作1g/mL)。
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的 盘,称量其质量。然后 (按操作的先后顺序选填字母),直至天平平衡。
A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码
该步骤中用烧杯而不用纸称量氢氧化钠的原因是 。
③用 量取所需要的水,倒入盛有氢氧化钠固体的烧杯中,用 搅拌,使其溶解,并冷却到室温。
④将配制好的溶液放入试剂瓶,塞好橡胶塞并 ,放到指定的地方。
(2)粗盐的初步提纯:
①称取5.0克粗盐,用药匙逐渐加入到10mL水中,直到粗盐不再溶解为止。还需进行的实验操作步骤的顺序为:称量剩余粗盐、 (填编号)。
A.过滤 B.计算产率 C.蒸发 D.称量精盐
②过滤操作如右图所示,指出其中的错误之处: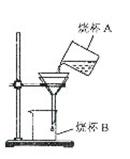
; ;
; 。
学习金属活动性顺序后,老师安排同学们开展系列实验探究金属间的置换反应规律。小明做完铝条和氯化铜溶液反应的实验后,将反应后的无色溶液(以下简称:待测溶液)倒入有水的废液缸中时,发现有白色沉淀析出的“异常现象”。小明设计实验开展了如下探究。请根据要求回答有关问题:
【发现问题】
小明取一滴管未倒完的待测溶液,将其注入盛有约三分之二试管体积的水中,依然产生大量白色沉淀(像牛奶一样)。
【提出问题】
待测溶液注入水中为什么有白色沉淀产生?白色沉淀是什么物质?
【查阅资料】
(1)AlCl3是一种无色透明晶体,极易与水反应生成难溶于水的Al(OH)3而产生白色沉淀;
(2)CuCl是一种不溶于水的白色固体,易溶于一定浓度的KCl、NaCl等含Cl﹣的溶液中;CuCl中Cu的化合价为 。
【提出猜想】
猜想Ⅰ:白色沉淀是Al(OH)3
猜想Ⅱ:白色沉淀是CuCl
猜想Ⅲ:白色沉淀是Al(OH)3和CuCl的混合物
【实验探究】
序号 |
实验操作 |
实验现象 |
实验结论 |
① |
取一滴管待测溶液,将其注入盛有约三分之二试管体积一定浓度的NaCl溶液中 |
无明显实验现象 |
猜想 正确 |
② |
取约2mL待测溶液于试管中,向溶液中插入足量洁净的Al条,充分反应 |
有红色固体析出 |
|
③ |
取一滴管实验②后的溶液,将其注入盛有约三分之二试管体积的水中 |
无明显实验现象 |
【结论与反思】
(1)上述实验表明,Al和CuCl2溶液的反应是分步进行的。第一步反应生成CuCl,第二步CuCl继续和Al反应生成Cu。请分别写出上述两步反应的化学方程式:第一步: ,第二步: 。
(2)待测溶液中含有大量CuCl,为什么它没有以白色沉淀的形式存在?请说明原因: 。
(3)设计实验③的目的是 。
【启示与拓展】
通过对Al和CuCl2溶液反应的实验探究,使我们认识到,我们不少的传统认识远没有做到细致入微,特别是当观察到有红色固体析出,于是就贸然断定这个反应是个简单的、一步完成的置换反应。实际上还要关注物质变化的过程,通过比较和分析,得出可靠的结论。经过无数次实验证明,有些化学反应看似一步完成,实际上是分步进行的。请根据你所学知识,任举一例反应可能分步进行的实例: 。
某校九年级“我们爱化学”活动小组的同学,在探究木炭与CuO反应时,完成了如图实验,请回答下列问题:

Ⅰ、如图所示装置进行实验,很快发现澄清的石灰水变浑浊;
(1)请写出C与CuO反应的化学方程式 ;
(2)实验结束时,应 (填写下列操作代号)。
①先撤出导管,再熄灭酒精灯
②先熄灭酒精灯,再撤出导管
Ⅱ、小组中华雪同学通过仔细阅读教材,认为当木炭较多、温度较高时,该反应产生的气体中可能含有CO和CO2,小组的同学们在老师指导下设计实验进行了验证:

已知:碱石灰是NaOH和CaO的混合物,可以吸收CO2和水。
(3)仪器B中所盛试剂为 ,其作用为 。
(4)D中玻璃管盛装的试剂为CuO,E中盛装的试剂为澄清的石灰水。若A装置产物中确有CO,则应观察到的现象有: 。
(5)实验前,需检查 ;点燃酒精灯前,先打开K,通入N2一段时间,其作用为 。
(6)请指出上述实验中的一项缺陷 。
(7)将1.44g炭和16.0g CuO在较高温度下反应生成Cu,理论上可生成 g CO。
Ⅲ、小组中吴华同学通过查阅资料发现:Cu2O为红色固体,难溶于水,可与稀硫酸反应生成Cu和CuSO4。
(8)请设计简单实验验证CuO和足量炭反应后所得的红色固体中是否有Cu2O:
。
在学习了单质碳的化学性质后,某化学兴趣小组的同学对含碳化合物燃烧后的产物进行了探究。
【提出问题】乙醇燃烧后的产物是什么?
【查阅资料】①无水硫酸铜为白色粉末,遇水会变蓝;
②氯化钙有吸水性,可做干燥剂。
【做出猜想】猜想一:产物中含有CO、H2O;
猜想二:产物中含有CO2、H2O;
猜想三:产物中含有(1) 。
【进行实验】同学们设计了如图的实验:检查装置气密性后,将乙醇燃烧的产物依次通过如图所示的装置进行验证;(部分夹持固定装置省略;B、D、G装置中均为澄清的石灰水)
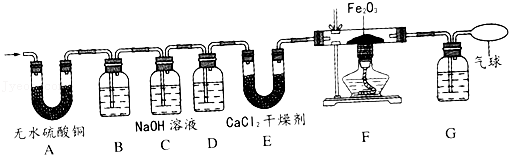
(2)装置B的作用是 。
(3)F装置中若发生反应,则化学方程式是 。
【解释与结论】经过实验,同学们认为猜想三成立。
(4)实验中能观察到的现象是① ;装置C中发生反应的化学方程式为② 。
【反思与评价】实验结束后,由于小丽同学的操作不当造成了仪器损坏,小组内同学针对这个事故,进行了分析和讨论。
(5)为了避免此事故再次发生,同学们对该装置进行了创新和改进,你认为他们的改进是 (文字说明或画图都可)。