化学兴趣小组的同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生。是不是拿错了药品?经检验确认没有拿错药品,而是氢氧化钠溶液变质了。
【分析】氢氧化钠溶液变质的原因是氢氧化钠与空气中的二氧化碳发生了反应。
【提出问题】该氢氧化钠溶液是全部变质还是部分变质?
【查阅资料】①已知反应: (白色)
(白色)
②氯化钡溶液呈中性。
【设计实验】依据查阅的资料设计实验步骤,并进行实验,根据实验现象推断相应实验结论。
取待测液于试管中,加入过量氯化钡溶液,将_______完全除去;
取反应后溶液于试管中,向其中滴入紫色石蕊溶液,发生的现象为____________。
【实验结论】该兴趣小组的同学得出的结论是:氢氧化钠溶液____________(填“部分”或“全部”)变质。
【进一步实验】该小组同学用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验。请你帮助他们解决下列问题:
(1)除去氢氧化钠溶液中存在的上述杂质可加入适量的____________,反应的化学方程式为 。
(2)借助于____________可判断盐酸和氢氧化钠溶液恰好完全反应。
下图是实验室制取气体的常用仪器,请根据要求填空:
(1)请写出上图中标有A的仪器名称:__________.
(2)若要在实验室制取二氧化碳气体,其发生装置可选择图中的__________进行组装(填仪器下方的序号,下同),其收集装置可选用图中的__________.检验二氧化碳是否收集满的方法是______________________________.
(3)若用图中⑥装置收集氧气,则开始收集氧气的最佳时机是______________________________
实验课上同学们对酸碱盐的性质作了如下探究。
(1)小海探究了中和滴定实验,操作如下图甲所示,当他观察到____________时,说明恰好完全反应。写出反应的化学方程式__________________。
(2)小郝对一瓶敞口放置的氢氧化钠溶液产生兴趣,他想探究该溶液是否完全变质。取样后先加入__________溶液,有白色沉淀生成。过滤。滤液中加入无色酚酞溶液,观察到溶液变红,他推断该氢氧化钠溶液部分变质。
(3)小亮则根据所学知识绘制了如下图所示物质间关系网络图,并做了相关实验。(“—”表示相连的两种物质能发生反应,“→”表示某物质可以转化为另一种物质。)已知A为胃酸的主要成分,B是贝壳的主要成分,D微溶于水,A与F反应生成气体。
① 写出物质D的俗称__________;
② 写出C→D 的现象_________;
③ 写出E→F的化学方程式_____________________;
④ 写出物质E的一点用途_________________;
结合下列实验室装置图,按要求回答下列问题。
(1)写出图中标号a的仪器名称 a____________
(2)实验室用加热氯酸钾的方法制取并收集较为纯净的氧气时,可选择的装置为_________,写出反应的化学方程式_____________________。
(3)装置C与装置B相比,优点是___________________________。
(4)写出一例用装置C和D制取气体的化学方程式_____________________。
(5)能用E装置收集的气体应具有的性质为________________。
某氯化钾样品含有杂质氯化钙和氯化镁,实验室提纯流程如下:
①实验过程中加入过量的K2CO3的目的是____________,X溶液中溶质是 ,加入该物质发生反应的化学方程式 .
②实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是 .
③本实验中蒸发是为了除去 (填化学式).
④若样品中含80gKCl,理论上最终所得KCl固体的质量 (填编号).
a.大于80g b.等于80g c.小于80g d.无法确定
小丽实验操作模拟考试的考题是:用碳酸钠溶液鉴别稀盐酸、食盐水和澄清石灰水。
【进行实验】
| 操作步骤 |
实验现象 |
实验结论 |
| 分别用A、B、C三支试管取样,然后各加入适量碳酸钠溶液 |
A中无明显现象 B中 C中 |
A中的物质是食盐水 B中的物质是稀盐酸,发生反应的方程式 C中的物质是澄清石灰水 |
【发现问题】如何处理上述废液才能减少对环境的污染?
【思考与分析】应先对废液中的溶质成分进行探究,后制定方案。
【实验与探究】
⑴小丽将所有废液倒入一洁净烧杯中,静置后得到上层清液;
⑵取少量清液加入足量的氯化钙溶液(中性),再滴加几滴无色酚酞试液,若出现 的现象,说明上层清液中一定有碳酸钠和氢氧化钠,一定没有 (填离子符号)。
【方法与应用】通过以上探究,处理上述废液的正确方法是 以减少对环境的污染。
某化学兴趣小组回收利用废旧干电池。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可于水。兴趣小组的同学们设计回收物质的流程如图1所示。

(1)操作1 和操作2 的名称都是,该操作中玻璃棒的作用是。
(2)灼烧滤渣 l 的目的是。
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度氯化锌的溶解度(填"<"、"="或">")。
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
① 应选择:发生装置为(填编号),排空气法收集装置为(填编号)。
② 若用排水法收集并测定气体的体积,气体从装置
导管口(填"
"或"
") 进;选用仪器
测量排出水的体积,仪器
名称是。

(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前
内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 |
试剂 |
前
内产生的氢气体积(
) |
|
| 不同纯度的锌 |
不同体积和浓度的稀硫酸 |
||
| a |
纯锌 |
30
30 % |
564.3 |
| b |
含杂质的锌 |
30
30 % |
634.7 |
| c |
纯锌 |
30
20 % |
449.3 |
| d |
纯锌 |
40
30 % |
602.8 |
① 比较实验
和实验
,可以得到的结论是。
② 为了研究硫酸浓度对反应快慢的影响,需比较实验和实验(填编号)。
③ 控制其他条件相同,需控制的条件是(例举一种条件即可)。
仓库中有一包氮肥的包装标签模糊不清,有同学进行了以下探究:
(1)操作③用玻棒搅拌的目的是。

(2)请完成下表(已知AgCl和BaSO4是难溶于水和酸的白色固体):
| 假设和现象 |
判断和化学方程式 |
|
| 若现象
为无氨味。 |
则样品中不含(填名称)。 |
|
| 由操作②现象判断。 |
该样品一定含有离子。 |
|
| 若现象
为白色沉淀,现象
为无沉淀。 |
则样品中含有(写名称),该反应的化学方程式为。 |
|
| 若现象
为"无沉淀",现象
为白色沉淀。 |
则样品中含有(写化学式),该反应的化学方程式为。 |
(3)若现象
、
都无现象,则该氮肥可能是(写化学式);若操作②现象为无气味、现象
、
无现象,则该氮肥可能是(只写一种)。
实验与探究是化学学习的重要方法和内容。
(1)今年5月,我市各学校进行了实验操作考查。小张同学进行的实验考查是"用稀盐酸鉴别氢氧化钠(
)溶液和碳酸钠(
)溶液,并测定碳酸钠溶液的
"。
①小张同学的实验记录如下表,请补充完整:
| 操作步骤 |
现象记录 |
反应的化学方程式 |
| 取两支试管,分别往试管中加入2
样品1、2,再往其中滴入盐酸 |
样品1:无明显现象 |
|
| 样品2:溶液中出现气泡 |
②用
试纸测定碳酸钠溶液的酸碱度,简述操作的主要步骤:。
(2)在实验台上有三瓶未贴标签的溶液,已知分别是碳酸钠溶液、氢氧化钠溶液和稀盐酸。为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按
、
、
进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如下图所示的探究活动:

步骤一中,
无明显现象,
、
溶液的颜色变成红色;
步骤二中,
、
溶液的颜色由红色变成无色,且
溶液中有气泡冒出。
①根据上述实验现象可知,
、
溶液分别是、。
②某小组同学在进行步骤一实验时出现异常现象:往
溶液中加入酚酞试液时,溶液颜色先变成红色,振荡后迅速变成无色。老师指出这是因为溶液浓度过大造成的。接着,老师往该试管的溶液中加入适量盐酸,观察到
溶液的颜色又变成红色,此时溶液中含有的溶质主要是(酚酞除外)。
酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有生成。
(2)某化学小组进行"酸和碱的中和反应"实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知
溶液呈中性。请填写下表:
| 实验操作 | 测定结果 | 白色固体成分 |
| 用 试纸测定反应后溶液的酸碱度,操作方法是 |
|
|
|
|
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)"粗盐提纯"指除去
中的泥沙和
、
、
等杂质。
某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的
、
、
溶液,充分反应后过滤,蒸发结晶。请回答:
| 部分物质的溶解性表(室温) |
||||
| 溶、挥 |
溶 |
溶、挥 |
||
| 溶 |
溶 |
不溶 |
不溶 |
|
| 微溶 |
溶 |
微溶 |
不溶 |
|
| 不溶 |
溶 |
溶 |
微溶 |
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入
溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充。
(4)
和
的化学性质相似。"神舟"飞船内,可用盛有
的过滤网吸收航天员呼出的气体,以降低
含量。请计算:用
完全吸收176
生成
和
,理论上至少需要
的质量是多少?
乙炔 气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为 )与水反应生成,同时生成一种白色固体.
【提出问题】白色固体是什么物质
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:
;
猜想二:;
猜想三:
.
他的依据是.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:.
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到,证明猜想二不成立.
(二)取少量白色固体加入到水中,取上层清液,,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:.
结论:白色固体是
.
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小.实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装是(选填图中装置序号).
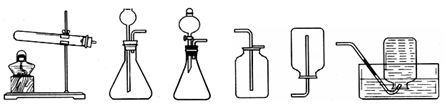
A B C D E F
化学小组同学为鉴定某工厂排出的无色污水成分,他们查阅工厂的有关资料后,推测出污水中可能含有
、
、
、
中的一种或几种物质,同学们取污水进行了探究:(已知
溶液呈中性)
(1)测污水的
:取一张
试纸,放在玻璃片上,读数为
,由此可知:污水中一定有,可能有
。
(2)检验
是否存在:甲同学在一支试管中取少量污水,向试管中滴加少量的溶液,振荡,产生了白色沉淀,反应的化学方程式为,证明污水中有
存在。乙同学用物理方法也得到了同样的结论,他的实验操作及实验现象是。
通过探究,同学们确定了污水的成分。
为使排放的污水中不含酸或碱,可向污水中加过量的。
同学们在实验室用5%的
溶液制取氧气并进行氧气性质实验。
溶液配制:用
30%的
溶液制取氧气(密度为1.13
)配制5%的
溶液(密度约为
)。溶液配制过程中,除用到玻璃棒外还需用到下列仪器中的。
| A. |
托盘天平 |
B. |
烧杯 |
C. |
漏斗 |
D. |
量筒 |
E. |
胶头滴管 |
气体制备:用配制好的5%
溶液和
制取
。请你在"
"、"
"两套装置中选择其中一套,并说明选择的理由,该反应的化学方程式为。待反应结束后同学们回收了混合物中的
,实验操作为。

性质实验:小明用收集好的氧气,进行了下面的实验:
把点燃的木炭伸入集气瓶中,实验现象是;为使铁丝在氧气中持续剧烈燃烧,他把光亮的细铁丝盘成螺旋状,,缓慢插入集气瓶中,观察到持续剧烈燃烧。通过实验得出,氧气可以支持燃烧,并且可燃物燃烧更剧烈。

某些食品的包装袋内,放有装有白色固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”。某同学对一袋久置在空气中的干燥剂进行了探究。
他先取部分久置的干燥剂倒入适量水中,充分搅拌、过滤,得到白色固体和滤液。然后对滤液的酸碱性和白色固体的组成作了探究。
【实验探究一】探究滤液的酸碱性
该同学测定了滤液的酸碱性,你认为该滤液显(填“酸性”、“碱性”或“中性”)。
【实验探究二】探究白色固体的组成
该同学认为白色固体中可能含有的物质是CaO、Ca(OH)2、CaCO3。
他查阅有关资料得知:
CaO是一种白色固体,俗称生石灰,能与水反应生成氢氧化钙,并放出热量。氢氧化钙微溶于水。
【分析判断】你认为该白色固体中一定不含有的物质是 。
【实验操作】下面是该同学设计的进一步探究白色固体组成的实验方案,请你和他一起完成实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量白色固体,倒入适量水,充分搅拌、静置; ②向上层清液中滴加无色酚酞溶液 |
上层清液呈现 色 |
白色固体中一定含有 氢氧化钙 |
| 另取少量白色固体放入试管中,滴加稀盐酸 |
|
白色固体中一定含有碳酸钙 |
【总结反思】
(1)只通过以上实验,还不能证明这袋久置于空气中的干燥剂是否含有CaO。请用化学方程式表示原因 。
(2)请你简述一个证明这袋干燥剂中含有较多量CaO的简易实验:
。
小明为探究
、
、
的金属活动性顺序,做了如下两个实验。请分析实验,完成填空。

(1)试管①中观察到的现象是:铝丝表面附着一层固体,溶液颜色变浅。
(2)试管②中发生了化学反应,现象明显,该反应的化学方程式是。
(3)通过实验探究,
、
、
三种金属活动性由强到弱的顺序是。