某同学利用下列装置进行气体的制取和收集实验。请回答下列问题。
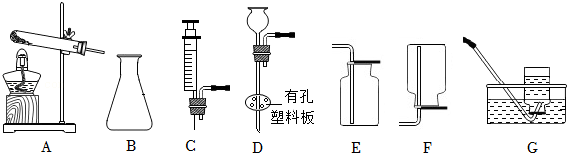
(1)写出仪器B的名称: 。
(2)实验室用加热高锰酸钾固体制取并收集氧气,应选用的装置是 (填字母序号,下同);所选装置中还需要改进的方法是 。
(3)实验室常用 (填药品名称)制取二氧化碳,发生装置要能达到“随开随起,随关随停”,需要选用的仪器有B和 。
(4)某同学选用B和C装置组合制取氧气,该组合的优点是 ,反应的化学方程式为 。
根据如图所示实验操作回答有关问题。
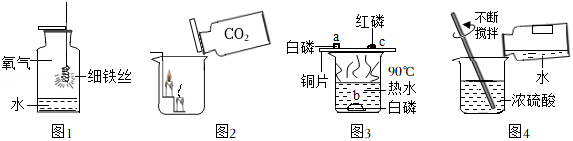
(1)图1实验中水的作用是 。
(2)图2实验,观察到的现象是 。
(3)图3是物质燃烧条件的探究实验,可观察到 (选填“a”“b”“c”)处的磷先燃烧。
(4)指出图4实验操作可能造成的后果 。
“珍爱生命,远离毒品”,冰毒是一种危害性很大的毒品,其主要成分是甲基苯丙胺(化学式为C10H15N)。某化学学习小组模拟对毒品的销毁,利用所制得的氧气燃烧冰毒,并检验所生成的二氧化碳气体,设计了如图实验。

本次实验只提供了如下化学试剂:5%的过氧化氢溶液,二氧化锰固体,浓硫酸,NaOH溶液,Ca(OH)2溶液,冰毒。请回答下列问题:
(1)仪器a的名称是 。
(2)为了完成此实验,除了选择装置B以外,还应选择的装置组合是 (填装置序号字母)。
(3)连接好装置,在加入药品前还必须进行的操作是 。
(4)检验二氧化碳时所发生反应的化学方程式为 。
我国“十四五”规划已经明确“2030年前实现碳达峰”的目标。碳达峰是指二氧化碳的排放达到峰值,不再增长。如图为自然界中CO2的循环图,图中箭头指向表示产生(排放)或消耗CO2的途径。回答下列问题:
(1)途径①需要消耗空气中的 。
(2)途径②中,枯枝败叶中的纤维素[化学式为(C6H10O5)n]在微生物作用下彻底转化为CO2和H2O,该转化中消耗O2与产生的CO2分子个数比为 。
(3)途径④通过光合作用吸收CO2的量白天 夜晚(填“大于”或“小于”)。

(4)途径⑤消耗的化石燃料是 (填“可”或“不可”)再生资源。
(5)降碳的一种途径是在合适的催化剂条件下,将二氧化碳与氢气反应使碳全部转化为乙烯(C2H4)、同时生成另一种化合物。请写出反应的化学方程式 。
(6)某年通过不同途径产生或消耗碳量的相对值如下表所示:
途径 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
相对值 |
0.6 |
60 |
60 |
121.8 |
5.5 |
92 |
90 |
据表可知,这一年大气中碳量增加了 (用表中相对值计算)。为达成“2030年前实现碳达峰”的目标,下列措施不可行的是 。
A.开发新能源
B.植树造林
C.禁止使用化石燃料
进一步分析上表回答:人口增多是否是大气中碳量增加的主要因素,并说明理由 。
钨(W)是一种重要的战略金属。实验室需用干燥的H2还原WO3制备金属W,所用装置如图所示。已知Zn粒中往往含有ZnS杂质,焦性没食子酸溶液可用于吸收氧气。回答下列问题:
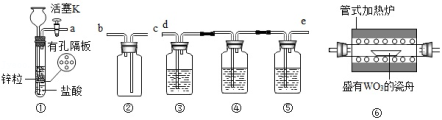
(1)装置①中用到的仪器有长颈漏斗、带导管的橡胶塞和 ,其反应的化学方程式有: 、ZnS+2HCl═ZnCl2+H2S↑。
(2)装置②的作用是安全瓶防倒吸,则a连接 (选填b、c、d或e)。
(3)装置③中盛装NaOH溶液,其作用是 。
(4)装置④⑤中盛装的溶液依次是 、 。
(5)装置①是启普发生器的简易装置,关闭活塞K后装置①中反应很快停止,其原因是 。
请同学们用如图装置完成相应气体的制取。

【资料】已知氨气是一种密度比空气小、极易溶于水且有刺激性气味的气体。以下两个反应均可产生氨气:
①碳酸氢铵受热分解:NH4HCO3 H2O+CO2↑+NH3↑
H2O+CO2↑+NH3↑
②熟石灰与氯化铵固体共热:Ca(OH)2+2NH4Cl CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
【解决问题】
(1)实验室若用加热熟石灰与氯化铵固体混合物的方法制氨气,其发生装置可选用上述装置中的 (填字母代号),在用D装置收集氨气时可在a端放置一团蘸有酚酞试液的湿棉花,以便 。在选择制取氨气的反应原理时,选用反应②而不选用反应①的理由是 。
(2)上述装置中X仪器的名称为 ,请写出一个用A装置制氧气的反应的化学方程式 。
化学是一门以实验为基础的科学。以下为初中化学常见实验,按要求回答问题。
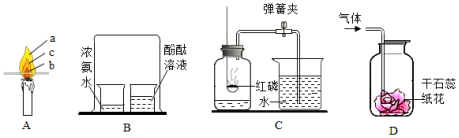
(1)图A木条放在蜡烛火焰上片刻后 (填序号)处炭化程度最大。
(2)图B发现酚酞溶液变红,说明分子的性质是 。
A.分子很小
B.分子在不断运动
C.分子之间有间隙
(3)图C红磷燃烧的化学方程式为 ,实验结束后,吸入左瓶的水量明显小于左瓶空气体积的 ,可能原因是 (填序号)。
A.红磷过量
B.气密性不好
C.燃烧完成后未冷却到室温打开止水夹
(4)图D气体是实验室制取的CO 2,发现干石蕊纸花变红,可能原因是 (写一条即可)。
某同学对收集满二氧化碳气体的集气瓶需要正放的必要性进行了探究。实验步骤如下:
①将有底的空纸筒盖上硬纸板,在电子秤上称得质量为5.39克;
②将该纸筒先后两次收集满二氧化碳气体,盖上硬纸板,分别正放、倒放在电子秤上,如图甲和图乙,观察并记录读数变化;
③将两次的读数变化绘制成图丙,并得出结论。
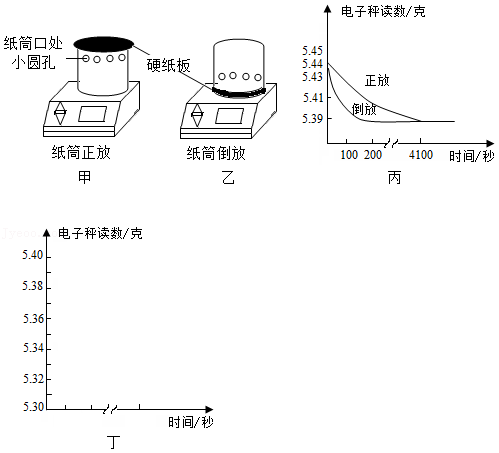
回答下列问题:
(1)检验二氧化碳收集满的操作是 。
(2)纸筒正放时,电子秤读数变小的原因是 。
(3)结合图丙推测,若纸筒内收集满的是氢气,请在图丁中画出纸筒正放、倒放时电子秤读数随时间的大致变化情况并标注。(纸筒收集满氢气后的质量为5.30克)
"加氢几分钟,畅行数百里",这是2021上海车展上为氢能源汽车打出的标语。氢能源汽车使用的是氢燃料电池(如图所示)。电池工作时在催化剂的作用下,氢原子失去电子形成氢离子,穿过电极A通过电解液移动到电极B与氧离子结合形成水分子;而电子则从电极A经外部电路通过电动机  到达电极B,形成电流。
到达电极B,形成电流。
(1)氢燃料电池工作时是将化学能直接转化为 能。
(2)氢气是氢燃料电池的原料,可以在用电低谷时,利用电网多余电能电解水来制取。已知1.2kg氢气大约可供某款氢能源汽车行驶100km,请根据化学方程式计算,制取1.2kg氢气至少需要电解多少质量的水。
(3)氢燃料电池工作时,通过电动机的电流方向是: 。
(4)世界能源组织提出:在制氢过程中基本上没有碳排放而得倒的氢气称为绿氢。下列方式可制得绿氢的是 。
| A. |
水力发电制氢 |
| B. |
太阳能发电制氢 |
| C. |
火力发电制氢 |
| D. |
核能发电制氢 |

20世纪30年代,美国科学家鲁宾和卡门利用18O分别标记H2O和CO2,将C18O2和CO2分别通入含小球藻的H2O和H218O中(如图所示),迅速收集产生的氧气。
(1)18O和16O互为 原子,H218O和H2O以及CO2和C18O2具有相同的化学性质,因此可以用来示踪物质变化情况。
(2)该实验是为了研究 。
(3)该实验必须在 条件下进行。
(4)制备含有较多小球藻的液体时,需在盛有小球藻的液体中加入 (选填“无机盐”或“无机盐和有机物”),并置于适宜环境下培养。

小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:

(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无明显现象,
(填写正确的实验操作及现象),证明滤液中含有Cl﹣。
在老师的指导下通过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。
小明通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2 3Fe+4H2O。
3Fe+4H2O。

当观察到 这一现象时,排除了四氧化三铁存在的可能性。
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液(能将Fe2+转化为Fe3+),然后滴加硫氰化钾溶液。溶液变为血红色,证明溶液中有Fe2+,得出加热棒中含有铁粉这一结论。
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式: 、 。
综合上述实验,小明验证了加热棒内的主要成分。
加热棒为什么能够起到加热作用呢?小明还将进一步探究。
化学是一门以实验为基础的科学。根据如图回答问题。
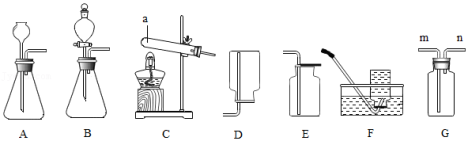
(1)仪器a的名称是 。
(2)实验室用过氧化氢溶液和二氧化锰混合制取氧气的化学反应方程式为 ,若用F装置收集氧气,当观察到 的现象时再开始收集。
(3)甲烷是一种没有颜色、没有气味、难溶于水、密度比空气小的气体。实验室常用加热碱石灰(氧化钙和氢氧化钠固体的混合物)和醋酸钠固体制取甲烷气体,应选用的发生装置是 (填标号,下同),若用G装置收集时,则气体要从 端通入。
(4)A、B装置都可以制取氧气、二氧化碳和氢气,若要控制液体滴加速率,获得平稳气流,应选择的发生装置是 。
(5)生活中常用草酸溶液除铁锈和瓷砖上的污渍。草酸晶体加热会发生如下反应:H2C2O4•2H2O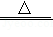 CO2↑+CO↑+3H2O。为检验分解后的产物,小赵设计了如图所示实验。回答下列问题。(白色的无水硫酸铜遇水变蓝)
CO2↑+CO↑+3H2O。为检验分解后的产物,小赵设计了如图所示实验。回答下列问题。(白色的无水硫酸铜遇水变蓝)
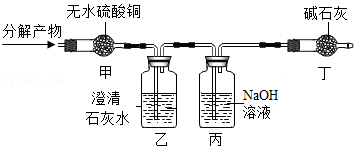
①实验中证明有水生成的现象是 。
②乙中澄清石灰水的作用是 。
③要证明有CO生成,在不连接其他装置的情况下,可进行的操作是 。
“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如图所示:

(1)流程中可循环利用的物质是 。
(2)膜反应器中发生的是分解反应,X的化学式是 。
(3)反应器中发生反应的化学方程式为 。
现有A~F六瓶失去标签的溶液,分别为澄清石灰水、硫酸铁溶液、碳酸钠溶液,稀盐酸、溶质质量分数为10%的氢氧化钠溶液和10%的氢氧化钾溶液。已知硫酸钠、硫酸钾溶液呈中性。某同学进行实验如下:
(1)从外观上观察,F呈黄色,则F为 。
(2)从剩余的五瓶溶液中各取少量溶液两两混合,可以观察到:A+D→白色沉淀,C+D→无色气体,其余无明显现象。则这五种溶液两两混合可发生 个反应,C为 ,A与D反应的化学方程式为 。
(3)取未鉴别出的B、E溶液各20g于两个烧杯中,分别滴加两滴酚酞溶液,再分别加入10%的稀硫酸17.5g(如图所示),并不断搅拌观察到B溶液由红色变为无色,E溶液仍为红色。则E为 溶液(填化学式)。
(4)将六瓶溶液贴上标签。