小红和同学们完成了实验室制取氧气和验证氧气性质的实验,并进行了相关问题的思考。请结合图文信息完成下列任务。

(1)图1:仪器a的名称是 ,给试管预热的操作是 ,发生反应的化学方程式是 。
(2)图2:当气体从b端进c端出时,可收集到的一种气体是 (写名称)。
(3)图3:点燃系在螺旋状细铁丝底端的火柴,待 时,插入集气瓶中。
A~E是初中化学5种常见的化合种物质,A、B、C的物质类别不同,“﹣”表示物质间相互反应,“→”表示一种物质生成另一种物质。A是生产玻璃、洗涤剂和日用化学工业的原料,D是常见的氧化物。
(1)A的化学式是 ,E的物质类别是 。
(2)B与C反应的微观实质是 。
(3)A与B发生反应的化学方程式是 ,实验现象是 。

碳捕捉与封存技术
“碳捕捉与封存”是我国的一项先进技术(如图所示)。
我国能源消耗的70%来自于煤炭。每秒有100吨煤在燃烧,年消耗量超过30亿吨。如果任由煤炭资源在诸多领域利用,将对大气、河流、土地产生污染,温室效应增强。为实现节能减排、绿色环保,我国政府举全国之力,积极倡导并大力发展新的绿色经济。比如:电厂中的煤在极高的温度下充分燃烧,会产生大量CO2,每年的排放量大约1600万吨,达用“碳捕捉与封存”技术,这些CO2将不会进入大气。被封存的CO2有许多用途,如用于食品保鲜、气体肥料、冷藏食物、物品灭火等,以此来消除资源的巨大浪费。我国正以超世界一流的目光发展经济,完善环保体制。
阅读文本,完成下列任务:
(1)“碳捕捉与封存”技术有利于控制 的加剧。
(2)煤在极高的温度下充分燃烧,主要发生反应的化学方程式为 。
(3)将分离聚集的CO2压入地下的过程中,分子间隔会 。
(4)将CO2封入蓄水层中发生反应的化学方程式为 。
(5)被封存起来的CO2用于冷藏食物的原理是 。

小洋同学看到妈妈在厨房拿食用碱水浸泡紫甘蓝时,紫甘蓝叶片边缘处变绿,感到很好奇。回到学校在老师的帮助下将紫甘蓝汁分别滴加到下列等体积、等浓度的五种溶液中,紫甘蓝汁显示的颜色如表:
物质 |
①稀HCl |
②NaCl |
③NaHCO3 |
④Na2CO3 |
⑤NaOH |
颜色 |
红色 |
蓝紫色 |
蓝色 |
绿色 |
黄色 |
[查阅资料]
pH |
<7 |
7 |
7.5﹣9 |
10﹣11.9 |
12﹣14 |
颜色 |
红色 |
蓝紫色 |
蓝色 |
绿色 |
黄色 |
[提高认识](1)紫甘蓝汁能作酸碱指示剂;
(2)上述五种溶液的pH值由大到小的顺序是 (填序号)。
[实验探究]为了便于观察实验现象,老师提议在用稀盐酸中和氢氧化钠溶液时应选用酚酞试液作指示剂,但小洋和兴趣小组的同学在做该实验时忘加了指示剂,因此未观察到明显现象。则该反应的化学方程式为 。
[提出问题]反应后溶液中溶质的成分有哪些?
[问题猜想]猜想一:NaCl 猜想三:NaCl,
猜想二:NaCl,NaOH 猜想四:NaCl,NaOH,HCl
兴趣小组的同学一致认为猜想四不合理,原因是 。
[设计实验]
步骤 |
现象 |
结论 |
|
方案一 |
取反应后的溶液于试管中,向其中滴加紫色石蕊溶液。 |
石蕊溶液变红 |
猜想三成立 |
方案二 (写一种) |
。 |
。 |
|
方案三 |
取反应后的溶液于试管中,向其中加入适量AgNO3溶液。 |
产生白色沉淀 |
[讨论交流]上述方案三不可行,原因是 。
[拓展应用]人体胃酸过多时可用 治疗。(化学式)(写一种)
根据下列装置,结合所学化学知识回答问题:

(1)写出有标号仪器的名称:① ② 。
(2)用氯酸钾制取氧气的化学方程式为 ,应选择的发生和收集装置是 ,若用装置G收集氧气则气体应从 (填“a”或“b”)通入。
(3)装置C与D组合,可制取的气体是 ,反应的化学方程式为: ;装置B和C对比,用分液漏斗代替长颈漏斗进行实验的优点是 。
(4)实验室用加热氯化铵和氢氧化钙固体混合物的方法来制取氨气。氨气密度比空气密度小,极易溶于水。则要选择的发生装置是 。
陈东同学在做“盐酸中和氢氧化钠”的实验时,实验前忘记向氢氧化钠溶液中滴加酚酞溶液,导致无法判断中和反应进行的程度,于是他对反应后溶液的酸碱性进行了探究。
[探究目的]确定反应后溶液的酸碱性
[猜想与假设]反应后溶液可能呈碱性,也可能呈 ,也可能呈 。
[实验验证]
实验操作 |
实验现象 |
实验结论 |
取反应后溶液少许,滴加几滴酚酞溶液 |
|
溶液呈酸性或中性 |
[继续验证]可以设计多种方案进行验证
实验操作 |
实验现象 |
实验结论 |
方案1:取反应后溶液少许,加入少量氧化铜粉末 |
若粉末部分或全部溶解,溶液变为蓝色 |
溶液呈 |
若粉末不溶解,溶液不变色 |
溶液呈 |
|
方案2:取反应后溶液少许,加入少量 |
若有气体放出,溶液变为浅绿色 |
溶液呈酸性,反应的化学方程式是 |
若 |
溶液呈中性 |
请结合如图实验装置,回答问题:

(1)写出标号①仪器的名称 。
(2)写出实验室用高锰酸钾制取氧气的化学方程式 ,可选择装置 (填序号)作为气体发生装置,但在该装置中还需要补充的是 。
(3)实验室常用大理石和稀盐酸制取二氧化碳气体,写出反应的化学方程式 ,收集气体应选用装置 (填序号);若将收集到的二氧化碳气体,沿烧杯内壁慢慢倒入装置F中,可以观察到的现象是 ,说明二氧化碳具有 的物理性质。
明明同学发现妈妈蒸馒头、炸油条时常常用到发酵粉或碱面。这是为什么呢?查阅标签得知:发酵粉的主要成分是碳酸氢钠和有机酸,碱面的主要成分是碳酸钠。带着这个问题,他和小组同学起走进实验室,展开了一系列的探究活动:
[设计与实验一]观察碳酸氢钠和碳酸钠都为白色粉末状固体。分别取两种固体少量于试管中,加水振荡至充分溶解,得到无色溶液。
[设计与实验二] (1) 在白色点滴板里进行如图1所示实验,观察到紫色石蕊溶液都变成 色。

(2)如图2分别取适量碳酸氢钠和碳酸钠粉末于试管中,滴加稀盐酸。观察到试管甲中都 ,试管乙中澄清石灰水都变浑浊。写出试管甲中反应的化学方程式 (任写一个)。
[归纳与总结]以上实验说明,碳酸氢钠和碳酸钠溶液都呈 性;都能与稀盐酸反应生成二氧化碳气体。大家认为:发酵粉或碱面能用来蒸馒头、炸油条,是因为 。
同伴芳芳提出猜想:蒸馒头、炸油条时温度都比较高,会不会是受热后它们都分解了呢?
[设计与实验三]芳芳和同学一起设计方案,并用如图所示的装置进行实验,请你帮她完成实验报告。
实验操作 |
实验现象 |
实验结论 |
|
加热碳酸氢钠时,试管内壁有水珠,澄清石灰水变浑浊。 |
碳酸氢钠受热 ,有水和二氧化碳气体生成。 |
加热碳酸钠时,试管内壁和澄清石灰水都没有明显变化。 |
|
[解释与结论]由此可知,芳芳的猜想 (填“正确”或“不正确”)。
通过以上实验,小组同学对碳酸氢钠和碳酸钠的性质有了较全面的认识,它们的性质既有相似之处,也有不同之处。同时,对物质的性质往往决定其用途,而物质的用途又反映其性质有了进一步理解。
某实验小组的同学完成“二氧化碳的实验室制取与性质”实验活动后,测得实验产生的废液pH<6.5(已知:酸、碱废液pH在6.5~8.5之间达到排放标准)。为准确测得废液中氯化氢的质量分数,同学们取了200g废液,当加入1.48g熟石灰时,测得溶液pH=7。
(1)试计算废液中氯化氢的质量分数。
(2)实验室的这类废液不要倒入下水道,应该 (写一条)。
通过近一年的学习,同学们一定深刻感受到化学就在身边,人类的衣、食、住、行都离不开化学,它使我们的生活变得更加绚丽多彩。请回答下列问题:
(1)你身上的衣服牢固耐穿、易洗快干、抗皱性好,是因为衣料大多都由 (填“合成纤维”或“天然纤维”)制成。
(2)自2018年以来,宁夏多地区启动深度净化黄河水替换地下水源供水,保障城乡居民饮水安全。黄河水自取水站经过沉淀、过滤、吸附、杀菌消毒,达到国家生活饮用水标准后,输送至千家万户。小刚通过 ,判断自来水仍然是硬水。饮用前,可 将其软化。
(3)你住的房屋建造时所用的各种材料也和化学有关。例如,用石灰浆粉刷过的墙壁,一段时间后,变得既白又坚固,其原理是 (用化学方程式表示)。
(4)“共享电动车”方便市民绿色出行,有效缓解了城市交通压力,减少了大气污染,成为现代城市的又一道靓丽“风景”。为防止电动车钢制车架与空气中的 等接触而生锈,通常在车架表面进行喷漆处理。
小文用如图所示实验测量粗锌中锌的质量分数(粗锌中的杂质既不溶于水,也不与稀硫酸反应)。试计算: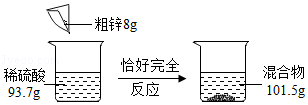
(1)生成氢气的质量;
(2)粗锌中锌的质量分数;
(3)恰好完全反应后所得溶液中溶质的质量分数。
氯气可与氢氧化钠溶液反应,其反应的化学方程式为:2NaOH+Cl 2═NaClO+NaCl+H 2O,其中生成的次氯酸钠(NaClO)易溶于水,为"84"消毒液的有效成分。现向某100g氢氧化钠溶液中通入一定量氯气,使之与氢氧化钠恰好完全反应,反应后的溶液质量为107.1g。请计算:
(1)参加反应的氯气质量为 g。
(2)反应生成次氯酸钠的质量(请写出计算过程)。
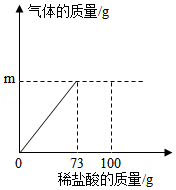
实验室用12.5g含碳酸钙80%的石灰石和一定质量的稀盐酸反应制取二氧化碳(石灰石中的杂质不溶于水,也不与稀盐酸反应),加入稀盐酸的质量与产生气体的质量关系如图所示,试计算该稀盐酸中溶质的质量分数。
实验室常用高锰酸钾(KMnO4)制取氧气,生活中常用0.1%的高锰酸钾溶液来消毒。
(1)高锰酸钾中钾、锰、氧三种元素的质量比为 。
(2)若要配制50g质量分数为0.1%的高锰酸钾溶液,需要质量分数为1%的高锰酸钾溶液 g。