含碳酸钙80%的石灰石125g ,向其中加入足量稀盐酸恰好完全反应(假设除碳酸钙外的其他杂质都不溶于水,且不与稀盐酸反应),
求:⑴二氧化碳质量
⑵二氧化碳体积为多少升?(此状态下二氧化碳的密度约为2.0克/升)(保留一位小数)
某同学想探讨过氧化钠与水的反应(2Na2O2+2H2O 4NaOH+O2↑),将15.6g过氧化钠加入盛有147.6g水(过量)的烧杯中充分反应,直至固体完全消失,不再有气泡产生。请计算:反应生成的氧气质量。
4NaOH+O2↑),将15.6g过氧化钠加入盛有147.6g水(过量)的烧杯中充分反应,直至固体完全消失,不再有气泡产生。请计算:反应生成的氧气质量。
某钙片的标签如下,且知钙片成分中只有碳酸钙中含有钙元素:

(1)请计算碳酸钙中钙元素的质量分数为 ;
(2)请通过计算推断此标签中的含钙量是 (填虚假或真实)的;
(3)某实验小组为测定其真实的含钙量做了如下实验,每次取10片钙片放入已称量的含足量盐酸的烧杯中,发生的化学反应是:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑,充分反应后再称取烧杯和剩余物质的总质量,数据如下:
| |
物质的质量 |
| 反应前:烧杯+盐酸 |
22g |
| 10片钙片 |
8g |
| 反应后:烧杯+剩余物 |
26.7g |
请计算此钙片中碳酸钙的质量分数。
某补钙药品说明书的部分信息如图所示。

现取4 片钙片放入100g稀盐酸中,有效成分完全反应(其他它成分不与稀盐酸反应),反应过程中质量的变化如下。
| 反应前 |
烧杯 |
50g |
| 4片钙片 |
8g |
|
| 稀盐酸 |
100g |
|
| 完全反应后 |
烧杯+剩余固体+液体的总质量 |
155.36g |
(1)反应生成二氧化碳的质量是 g。
(2)通过计算回答,该补钙药品说明书中碳酸钙的含量与实际是否相符。
科学家经过多年研究证明,某些零食中含一定量对人体健康有害的物质,如油炸
食品中常含有致癌物质丙烯酰胺(C3H5NO)。
(1)丙烯酰胺的一个分子是由 个原子构成;
(2)丙烯酰胺的相对分子质量是 ;
(3)丙烯酰胺中碳元素的质量分数是 ;
(4)丙烯酰胺中碳元素和氧元素的质量比 ;
(5)卫生部建议,每天丙烯酰胺的摄入量不多于1μg/kg×体重(kg)。50g某品牌薯片中含丙烯酰胺150μg。若你的体重为50kg,你每天最多吃这种薯片 g。
现将30g氯酸钾与二氧化锰的混合物充分加热,冷却后称得剩余固体的质量为20.4g。
请计算:
(1)生成氧气的质量。
(2)反应前混合物中氯酸钾的质量分数。
(1)帕拉米韦氯化钠注射液是治疗H7N9亚型禽流感的有效药物之一,帕拉米韦的化学式是C15H28NxO4。求:
①帕拉米韦中氢元素与氧元素的质量比是 (填最简比),
②帕拉米韦的相对分子质量为328,则氮元素的质量分数是 (精确到0.1%)。
(2)用“侯氏联合制碱法”制得的纯碱(Na2CO3)常含有少量的NaCl。为测定某纯碱样品中Na2CO3的含量,小明称取该纯碱样品5.5g,充分溶解于水中,再分别滴加稀盐酸至反应不在产生气体,产生气体的质量与加入稀盐酸的质量关系如图所示。
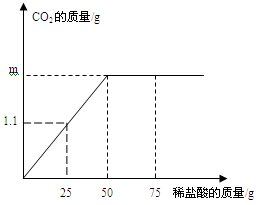
发生的化学反应方程式是:Na2CO3 + 2HCl ="=" 2NaCl + H2O + CO2↑,求:
①生成二氧化碳的质量m是 g.
②该纯碱样品中Na2CO3的质量分数。(精确到0.1%)
某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4 g钢样品和30.0 g稀盐酸(足量)放入质量为130.0 g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量,记录如下表:
| 反应时间 |
T0 |
T1 |
T2 |
T3 |
| 烧杯和药品质量/ g |
171.4 |
171.3 |
171.0 |
171.0 |
(1)计算这种钢样品中铁的质量分数。(最后结果精确到0.1%)
(2)某钢厂欲冶炼1120 t这种钢材,需含氧化铁80%的赤铁矿多少吨?
家用漂白剂的有效成分是次氯酸钠(NaClO ),其制备反应的化学方程式是:Cl2+2NaOH ═NaCl+NaClO+H2O。若要制备149kg的次氯酸钠,则理论上需要氢氧化钠的质量是多少?
石灰石是常用的建筑材料。
①甲乙同学设计了如下实验方案进行探究:

Ⅰ.甲同学取石灰石按图所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,由此甲同学认为石灰石已分解。甲同学结论不合理的理由是 。
写出石灰水变浑浊的化学方程式 。
Ⅱ.乙同学进行如下实验,完成下表
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量煅烧后固体于试管中,加水振荡,过滤,取滤液,滴加 溶液 |
溶液变红 |
证明固体中 含有 |
| 取滤渣滴加足量的稀盐酸 |
|
含有碳酸钙 |
②为了测定石灰石中碳酸钙的质量分数(假设杂质不参加反应),乙同学设计称取石灰石样品100g,高温煅烧至质量不再改变。实验中固体的质量变化如下:

Ⅰ.生成二氧化碳的质量是 g。
Ⅱ.求石灰石中碳酸钙的质量分数。(根据化学方程式列式计算)
M g某石灰石样品与足量稀盐酸反应(杂质不反应),共生成0.1mol二氧化碳。请计算:
① 参加反应的碳酸钙的质量。(请根据化学方程式列式计算)
② 已知该样品中含碳酸钙80%,则M= g。
鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量分数,某同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10克放在烧杯里,然后往烧杯中加入足量的稀盐酸90克,充分反应后,称得反应剩余物为97.14克(假设鸡蛋壳中的其它物质不与稀盐酸反应)。请计算:
(1)产生二氧化碳气体多少克。
(2)计算该鸡蛋壳中碳酸钙的质量分数。
已知碳酸氢铵的化学式为NH4HCO3,计算:
(1)碳酸氢铵的相对分子质量 .
(2)碳酸氢铵中各元素的质量比 .
(3)158gNH4HCO3中含氮多少克 .
计算题:某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
①称取25.0g石灰开佯品,平均分成两份,并分别加工成块状和粉末状;
②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如下图所示:

请回答:每份样品充分反应后.生成二氧化碳的质量为 g;该样品中碳酸钙的质量分数为多少呢
欲冶炼含铁96%生铁336t,需要含杂质20%的赤铁矿多少(杂质中不含铁)?