、钛合金是21世纪的重要材料。工业上制取金属钛(Ti)的一个反应的化学方程式为:TiCl4 + 2Mg  Ti + 2MgCl2。制取金属钛12t,可同时生成副产品氯化镁多少吨?
Ti + 2MgCl2。制取金属钛12t,可同时生成副产品氯化镁多少吨?
(10梧州50).现有硫酸和硫酸铜的混合溶液200 g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图20所示。求:
(1)Cu(OH)2的相对分子质量是 。
(2)生成最大沉淀量时所加入的氢氧化钠溶液的总质量。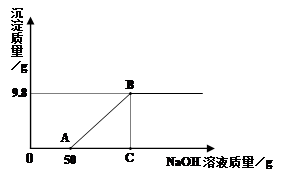
(10菏泽15)、用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质)。称量某纯碱样品12g,全部溶解在100g水中,所得溶液与160g氯化钙溶液混合,恰好完全反应。过滤干燥后,称得沉淀质量为10g。请计算:
(1)纯碱样品中碳酸钠的质量分数。
(2)反应后所得滤液中溶质的质量分数。
(10大连57).某补钙剂的主要成分是碳酸钙。为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加入稀盐酸至不再产生气泡为止(其他成分不含钙元素,不溶于水也不与稀盐酸反应)。过滤,得到滤渣2.5g,将滤液蒸干,得到氯化钙11.1g。计算:
⑴该补钙剂中碳酸钙的质量分数;
⑵某人除正常饮食之外,每天需补充0.64g钙元素,则每天需服用这种补钙剂多少克?
某校兴趣小组探究学校附近赤铁矿中Fe2O3的纯度。他们采集了80g矿样,粉碎后均分成四等份,分别置于四个烧杯中,然后分别向四个烧杯中加入同一浓度的稀硫酸,加入硫酸的质量与反应后剩余固体质量如下表所示。(假设矿石中的杂质既不和稀硫酸反应,也不溶于水)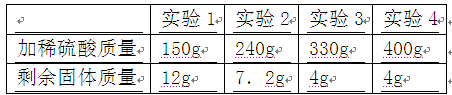
求:(1)该矿样中Fe2O3的质量分数。
(2)所用稀硫酸的溶质质量分数。
(10南充18)下图是某种胃药的部分标识。胃药中所含物质能中和胃液里过多的胃酸(主要是盐酸)。
某患者按标识上的服用方法服药,服药三天后病情好转。请计算患者在三天内所服的此胃药中:(计算结果保留一位小数)
(1)所含氢氧化镁的质量为多少?
(2)理论上可中和胃酸中的HCl质量是多少?
某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4 g钢样品和20.0 g稀盐酸(足量)放入质量为120.0 g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量,记录如下表:
| 反应时间 |
T0 |
T1 |
T2 |
T3 |
| 烧杯和药品质量/ g |
151.4 |
151.3 |
151.0 |
151.0 |
(最后结果保留一位小数)
(1)反应中产生氢气的质量是 g。
(2)钢的类型分为:
| 低碳钢 |
中碳钢 |
高碳钢 |
| 含碳量0.03%~0.3% |
含碳量0.3%~0.6% |
含碳量0.6%~2% |
假设残留在烧杯中的黑色固体全部是碳单质,试通过计算判断这种钢属于哪种类型的钢?
(3)某钢厂欲冶炼1000 t这种钢材,需含氧化铁80%的赤铁矿多少吨?
蛋白质是由多种氨基酸组成的。蛋白质中氮元素的平均质量分数为16﹪。通过计算回答下列问题:
(1)蛋氨酸是氨基酸的一种,化学式为C5H11O2NS,求蛋氨酸中氮元素的质量分数?
(2)合格奶粉的质量标准为:每100克奶粉中含蛋白质18克。现测得100克某奶粉含有的蛋白质中氮元素的质量为0.5克,这种奶粉是否合格?
近年来,我市积极探索建设新农村的服务体系,许多农户获得“测土配方施肥”服务,有效解决了施肥比例不合理问题,提高了农作物产量,减少对环境的污染。小明家种了一片麦子,经农科人员测定该片土壤需补充钾元素39kg,氮元素42kg。请你帮小明算算,至少需购买硝酸钾、硝酸铵各多少千克?
小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定。他们从瓶中取出该溶液共51 g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示:则该溶液中所含双氧水的实际质量是多少克? 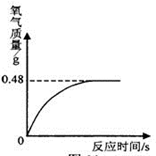
核事故时往往泄漏出污染物(具有放射性的碘原子)。为避免核辐射,需一次性口服100毫克不具放射性的碘原子,使人体甲状腺中碘达到饱和而不再吸收外界的碘,从而起到保护作用。假设所处的环境已受污染,通过服用加碘食盐的方法能否有效起到避免核辐射的目的呢?
【查阅资料】成人每天食用食盐的质量通常为6g;某种加碘食盐的标签如图所示。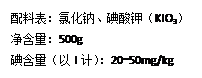 ⑴碘酸钾(KIO3)的相对分子质量为___________;
⑴碘酸钾(KIO3)的相对分子质量为___________;
⑵碘酸钾中K︰I︰O的元素质量比为___________;
⑶碘酸钾中碘元素的质量分数为___________;
⑷每袋加碘盐至少含碘酸钾多少毫克?
(要求:写出必要的计算步骤,计算结果保留一位小数)
【问题分析】若要使人体甲状腺中的碘达到饱和,至少需要一次性食用该品牌碘盐____kg。
【结论】日常服用加碘食盐_①_(填“能”或“不能”)起到避免核辐射目的,原因是___②__。
今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
| 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
3.52 |
(1)表中X的值为 ;
(2)求样品中碳酸钙的质量分数。
小苏打(主要成分为NaHCO3)中常含有少量氯化钠。
化学兴趣小组的同学为了测定某品牌小苏打中NaHCO3的质量分数。进行了以下实验:称量
样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所
示。
| 物 质 |
样 品 |
消耗稀盐酸质量 |
反应后溶液质量 |
| 质量(g) |
9 |
75.4 |
80 |
试计算:(计算结果保留一位小数)
(1)样品中的NaHCO3质量分数;
(2)所得溶液中NaCl的质量分数。
现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:
| 反应时间/s |
20 |
20 |
20 |
20 |
20 |
20 |
| 质量/g |
119.52 |
118.64 |
117.76 |
116.88 |
116 |
116 |
请计算回答:(1)样品中碳酸钙的质量分数。(计算结果保留1位小数)
(2)反应后所得溶液中溶质的质量分数。
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算: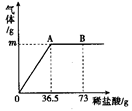
⑴A点产生气体的质量为 ;
⑵试样中碳酸钠的质量分数(结果精确到0.1%);
⑶B点时,烧杯内溶液中溶质的化学式 。