下列厨房常见物质的用途不正确的是( )
A.氯化钠可作调味品
B.利用洗涤剂的乳化作用清洗餐具上的油污
C.用淀粉溶液检验加碘食盐是否含碘
D.水壶中的水垢用白醋浸泡除去
如图是测定空气中氧气含量的实验装置图及主要步骤.请补充;

(1)将一支具支试管装满水,塞上胶塞.然后打开胶塞,将水倒入量筒中,记录体积为30ml.本操作的目的是
(2)先预热然后再固定在铜粉部位加热,加热时要不断推拉注射器,目的是 .观察到的现象是
(3)根据下表提供的实验数据,完成填空:
| 硬质玻璃管中空气的体积 |
反应前注射器中中空气的体积 |
反应后注射器中中空气的体积 |
实验测得空气中氧气的体积分数 |
| 25ml |
15ml |
8ml |
17.5% |
(4)若实验测得的结果偏小,可能的原因有那些?(列举两条) ,
(5)实验拓展:下图是测定氧气含量的三种方法

①图1与图2比较有什么缺点?.
②利用图3进行实验,白磷在热水加热的条件下会着火燃烧,整个过程中活塞的移动方向是 ;充分冷却后活塞应停留在 .(填数字).
③金属镁条不仅与氧气反应,还能与空气中的氮气、二氧化碳反应.如果把图1中的红磷换成镁条,则实验结果偏 (填大或小).
某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数.氢气可由锌和硫酸反应获得,同时生成硫酸锌.设计的实验装置如图:某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数.氢气可由锌和硫酸反应获得,同时生成硫酸锌.设计的实验装置如图:

(1)写出仪器名称:A ,D .
(2)甲中发生反应的化学方程式为: .
(3)实验前关闭开关C,打开开关B,在甲中加入锌粒和稀硫酸发生反应后用试管收集氢气并检验其纯度,若听到尖锐的爆鸣声说明氢气 .再次检验氢气纯净后,点燃氢气并迅速插入乙装置中,直至火焰刚好熄灭时关闭开关B,冷却至室温后,下一步操作是 ,在乙中观察到的现象是 ,即达到实验目的.
(4)已知CO气体能在空气中燃烧生成CO2,若将如图中的甲装置撤去,用CO气体代替氢气进行上述实验,实验 (“能”或“不能”)达到同样的目的?若能,说明理由;若不能,应如何改进? .
下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )
| A.紫色石蕊溶液 | B.氯化钠溶液 | C.铁粉 | D.pH试纸 |
下列实验方法无法达到实验目的是( )
| A.用肥皂水鉴别硬水和软水 |
| B.用燃着的木条鉴别氮气与二氧化碳 |
| C.用熟石灰中和废液中的盐酸 |
| D.用紫色石蕊试液鉴别稀硫酸和蒸馏水 |
下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )
| A.紫色石蕊溶液 | B.氯化钠溶液 | C.铁粉 | D.pH试纸 |
鉴别空气、氧气和二氧化碳三瓶气体,最常用的方法是( )
| A.分别测定它们的密度 |
| B.观察颜色并闻它们的气味 |
| C.将燃着的木条分别伸入集气瓶中 |
| D.将气体分别通入紫色石蕊溶液中 |
除去溶液中的少量杂质,试剂选择正确的是
| 选项 |
溶液 |
杂质 |
试剂 |
| A |
NaNO3 |
Na2CO3 |
适量BaCl2溶液 |
| B |
CaCl2 |
稀盐酸 |
足量CaCO3固体 |
| C |
ZnSO4 |
CuSO4 |
足量铜粉 |
| D |
Fe2(SO4)3 |
Na2SO4 |
足量NaOH溶液 |
A.A B.B C.C D.D
如图为配置50g溶质质量分数为10%的氯化钠溶液的操作过程,下列有关操作与目的分析均正确的是

| 选项 |
操作 |
目的 |
| A |
用剩的食盐放回原试剂瓶 |
避免浪费 |
| B |
天平调平后在左、右托盘中各垫一张相同的纸 |
保证称取的食盐质量更准确 |
| C |
用50ml量筒替代天平量取所需的水 |
更加简便 |
A.A B.B C.C
下列实验中利用提供的实验方案不能达到相应实验目的的是
| 选项 |
实验目的 |
实验方案 |
| A |
区别铁粉和四氧化三铁粉末 |
加入稀盐酸,观察有无气泡产生。 |
| B |
区别二氧化碳气体和空气 |
将带火星的木条伸入气体中,观察木条是否复燃。 |
| C |
区别食盐水与蒸馏水 |
分别用玻璃棒蘸取水样,灼烧,观察有无固体析出。 |
| D |
比较20℃时固体氯化钠和蔗糖的溶解度大小 |
20℃时,各取100mL水,分别逐渐加入氯化钠和蔗糖,搅拌,直至不再溶解,比较两者最终溶解的质量大小。 |
利用下图装置在实验室模拟炼铁,并将得到的尾气中的一氧化碳和二氧化碳进行分离和收集。(提示:NaOH溶液可以吸收CO2气体。)
实验步骤如下:

(1)检查装置气密性。
(2)取一定质量的氧化铁加入硬质玻璃管中,其它容器中各加入适量试剂(如图所示)。
(3)关闭分液漏斗开关和K2,打开K1,通入CO气体一段时间,排除装置内的空气。此时装置存在的缺陷是 。
(4)继续通CO,在出口M处将气体干燥并用小试管收集后检验气体纯度。待装置内气体纯净后,打开分液漏斗开关K,将足量的氢氧化钠溶液放入锥形瓶中,使液面没过导管下端,关闭开关K,点燃酒精喷灯,装置A的玻璃管中反应的化学方程式是 。当装置C中的现象是____________时,说明装置B中的反应是充分的,立即关闭K1,打开K2,装置D中收集到的气体是CO。
(5) 一段时间后,停止加热,继续通CO气体至装置A的药品冷却。经称量氢氧化钠溶液增重2.64 g,此时生成Fe的质量是__________g(结果精确到0.1g)。
有三瓶无色无味的气体,分别是氧气、空气、二氧化碳,区别它们最简单的方法是
| A.伸入燃烧的木条 | B.测定气体的密度 |
| C.滴入澄清石灰水,振荡 | D.滴入紫色石蕊试液,振荡 |
下列物质A、B、C、D都是初中化学中的常见物质,它们之间具有如下图所示的转化关系(反应条件、有些反应物或产物已略去)。其中A与B的组成元素相同,且都为无色液体,C可使带火星的木条复燃,D是一种无色气体单质。
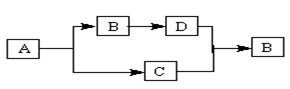
(1)试写出下列物质的化学式:B为 。
(2)写出下列反应的化学方程式:
A→B ;D→B
下列实验目的对应的实验方法不正确的是( )
| |
实验目的 |
实验方法 |
| A |
鉴别二氧化碳、一氧化碳 |
分别将两种气体通入澄清的石灰水 |
| B |
鉴别水和过氧化氢溶液 |
加入二氧化锰,观察是否有气泡 |
| C |
纯水和矿泉水 |
观察是否澄清 |
| D |
比较空气和人呼出气体中CO2的含量 |
加入澄清石灰水并振荡,观察现象 |
实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制二氧化硫气体。二氧化硫气体是无色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成亚硫酸(H2SO3)。
(1)试写出实验室制取二氧化硫气体的化学方程式:(提示:该反应与碳酸钙和稀盐酸的化学反应原理相似)_____________________。
(2)制取二氧化硫时,应选用下图所示的 装置(填代号,下同);收集二氧化硫气体时,应选用下图所示 的装置。

(3)二氧化硫气体与硫化氢气体常温下混合反应,生成黄色固体硫(单质)和水。试写出此反应的化学方程式 。
(4)二氧化硫气体排放到空气中会污染空气。二氧化硫气体不能被稀硫酸吸收,可被水吸收,用碱液(如NaOH)吸收效果最好。因此,我们应选用右图所示的 洗气装置(想想:填A、B还是C呢?),在洗气时,二氧化硫气体应从该装置的_________________端通入(是填a,还是填b呢?)。
