作物的无土栽培可以显著提高产品的产量和质量。某茄子的无土栽培营养液中含有7%的KNO3。请回答下列问题:
(1)KNO3属于 (选填“氮肥”、“钾肥”、“磷肥”或“复合肥料”)。
(2)要配制150kg该营养液,需要KNO3的质量 kg。
2011年3月,日本强烈地震后,海啸引发福岛第一核电站的放射性物质外泄,有关
(碘-131)的相关报道成为热门话题。请回答下列问题:
(1)
原子中含有53个质子,78个中子。
①
原子的核外电子数为。
②自然界中普遍存在另一种稳定的碘原子
,它和
同属于碘元素。
原子的质子数为。
(2)专家指出,服用碘片(有效成分为
)可以治疗
造成的辐射,但服用碘酒(有效成分为
)却会引起碘中毒。
和
的性质不同的原因是。
(3)日本地震后,个别居民抢购食盐。假设某人经医生确认,每日需要补充166
。已知每千克某品牌碘盐中
的加入量为42.8
,如果用该食盐替代碘片提供治疗辐射所需的碘元素,则每日需食用该食盐的质量为
.
(4分) 儿童缺锌会引起食欲不振、发育不良.右图为某种补锌口服液说明书的一部分.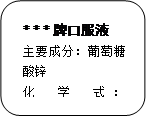
请回答:
(1)该口服液中的锌属于 ▲ (填:“常量”或“微量”)元素;
(2)计算组成葡萄糖酸锌中的碳、氢元素的质量比?
(3)计算葡萄糖酸锌中碳元素的质量分数为多少?(精确到0.1%)
(4)若儿童1kg体重每日需要0.5mg锌,每天从食物中只能摄入所需锌的一半;体重为20kg的儿童每天还须服该口服液 ▲ 支,才能满足身体的需要.
科学家经过研究,发现二氧化碳也是一种宝贵的碳氧资源.以
和
为原料合成尿素
是同定和利用
的成功范例.它还可以与氢气反应生成多种有 机物,如甲烷(
)、乙烯(
)等.试计算:
(1)
中碳、氢元素的质量比.
(2)
中氮元素的质量分数.(计算结果精确到0.1%)
(3)
转化为
的化学方程式为:
,若用24g
转化
,则理论上能生成
多少克(列式计算)?
实验室常用石灰石与稀盐酸制取
,某同学设计了两种制取
的部分装置(见右图).

(1)实验室制取
的化学方程式为:·
(2)仪器A的名称是: ,
(3)图1装置的不规范之处是: ;
(4)用图2装置
时,要使反应停止,最简便的操作方法是: ;
(5)实验时,向盛有石灰石的试管中加入足量稀盐酸后,发现石灰石表面仅有极少量气泡产生,原因可能是;
(6)若实验室需制备2.2 L
;.理论上需纯度为80﹪的石灰石多少克,(假设该状态下
的密度为2克/L)。
无土栽培是一种农业高新技术,它可以显著提高农作物的产量和质量。某品种茄子的无土栽培营养液中含有6%的
。
⑴
属于(填"钾肥"、"氮肥"或"复合肥料");
⑵
的相对分子质量为;
⑶
中钾、氮、氧元素的质量比为;
⑷要配制150
该营养液,需要
的质量为
。
如图是兴农化肥厂包装袋标签上的部分文字。请你通过计算填空:

(1)尿素中碳、氧、氮、氢元素的质量比是。
(2)这种化肥实际含尿素的质量分数为(结果精确到1%)。
右图是某品牌补铁剂的标签。请回答:
(1)富马酸亚铁颗粒中的铁属于元素(填"常量"或"微量");
(2)富马酸亚铁中
、
元素的质量比为;
(3)已知富马酸亚铁(
)中铁元素的质量分数为33%,若每次服用1包该补铁剂,摄入铁元素的质量为mg。

农技人员采用“测土配方”技术对一片果园进行了土壤检测,结果显示该果园需要补充一定量的氮元素和钾元素。
(1)、氮是植物生长的重要元素,果园土壤中缺少氮元素,需要用氮肥来补充,下列属于氮肥的是 (填序号)。
①KCl; ②NH4HCO3; ③Ca3(PO4)2。
(2)、某同学取丰收牌钾肥(如上图)样品2.0g,溶于足量的水中,滴加过量氯化钡溶液,产生沉淀质量与所加氯化钡溶液质量的关系如右图。试通过计算判断该钾肥中硫酸钾的质量分数是否符合产品外包装说明?(反应方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应。)
已知碳-12原子的质量是1.993×10-26kg,而一个x2分子的质量是3.348×10-27kg,求:x原子的相对原子质量(精确到0.1).
某课外活动小组按右图所示装置制取二氧化碳,并检验二氧化碳的性质:若用装置B来证明二氧化碳与水反应生成碳酸,B中除有少量水外,还应加入的试剂是 ,当①、②导管口连接时,B中看到的实验现象是: ,
其反应的化学方程式为: 。
当导管断开一段时间后,看到B中的现象是 ,
其反应的化学方程式为: .
为测定当地石灰石含碳酸钙的质量分数,该课外活动小组取来一些矿石,并取稀盐酸200g,将其平均分成4份,进行实验,其结果如下:
| 实验 |
第1份 |
第2份 |
第3份 |
第4份 |
| 加入样品的质量/g |
5 |
10 |
15 |
20 |
| 生成CO2的质量/g |
1.54 |
3.08 |
4.4 |
m |
依据表中数据请分析计算:
(1)哪几项反应中盐酸有剩余 。
(2)上表中m的数值是 。
(3)试计算这种石灰石中碳酸钙的质量分数。
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程
中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 反应后固体的质量m∕g |
80 |
75 |
70 |
66 |
62 |
58 |
58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.
(3)请在右面坐标图中,画出煅烧时生成气体的质量(m)
随时间(t)变化的曲线.
用“侯氏制碱法”制得的纯碱中常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的质量分数,小明称取该样品11 g,加入到盛有50 g稀盐酸的烧杯中,恰好完全反应,称得烧杯中的溶液质量为56.6 g。请计算:
(1)完全反应后生成二氧化碳的质量为 g。
(2)该纯碱样品中碳酸钠的质量分数。(精确到0.1%)
某部分变质的NaOH试剂经处理后只含有NaOH和Na2CO3两种物质。小明同学从中均匀取出9.3g样品用19.9g水溶解后,再向其中缓慢滴加10%的稀盐酸至恰好完全反应时,用去稀盐酸73g,经测定共放出气体2.2g。
(1)向样品中加入稀盐酸至恰好完全反应时,发生的两个反应可用化学方程式表示为:
_______________________________________,_______________________________________;
9.3g样品中,含Na2CO3的质量为_____________g,含NaOH的质量为_____________g。
(2)通过计算确定原NaOH试剂的变质程度。(用质量百分数表示)
(3)上述恰好完全反应后的溶液中,溶质的质量分数是多少?(用百分数表示,保留一位小数)