2020年9月,中国向世界宣布了2030年前实现碳达峰、2060年前实现碳中和的目标。
(1)为减缓大气中二氧化碳含量的增加,下列措施可行的是 (填序号)。
A.植树造林,开发和利用太阳能、水能、风能等新能源
B.禁止使用煤、石油、天然气等化石燃料
(2)绿色植物通过光合作用吸收二氧化碳,生成葡萄糖并放出氧气,其反应的化学方程式:6CO2+6H2O 葡萄糖+6O2,则葡萄糖的化学式为 。若吸收44g二氧化碳,理论上可释放出氧气 g。
葡萄糖+6O2,则葡萄糖的化学式为 。若吸收44g二氧化碳,理论上可释放出氧气 g。
(3)近年我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(CH3OH)和水,该反应的化学方程式为 。
(4)将一氧化碳和二氧化碳的混合气体3.2g通过足量灼热氧化铜粉末,充分反应,将所得的气体全部通入足量的氢氧化钡溶液中,气体全部被吸收,生成白色碳酸钡沉淀,溶液质量减少15.3g。则原混合气体中碳、氧元素的质量比为 (填最简比)。
古代“丝绸之路”把中国的丝绸、茶叶传入西方,将西方的宝石传入中国。茶叶中含有维生素C(化学式为C6H8O6),请回答下列问题:
(1)维生素C属于 (填“有机”或“无机”)化合物。
(2)维生素C是由 种元素组成,其中碳、氢两种元素的质量比为 (填最简整数比)。
(3)将维生素C在一定质量的氧气中充分燃烧,生成CO、CO2和H2O,测得生成物的总质量为30.4克,其中水的质量为7.2克,则参加反应的氧气质量为 克。
大量实验证明,化学反应符合质量守恒定律。
(1)如图是铁钉与硫酸铜溶液反应的实验。
①反应一段时间,观察到的现象是 ;
②该反应的化学方程式是 ;
③溶液中减少的铜元素质量等于反应生成的 的质量。
(2)取足量的铁、锌,各加入相同质量相同溶质质量分数的稀盐酸,完全反应后,铁、锌均有剩余,下列说法正确的是 。
| A. |
生成氢气的质量相等 |
| B. |
生成的氯化亚铁和氯化锌的质量相等 |
| C. |
参加反应的铁和锌的质量相等 |
| D. |
参加反应的稀盐酸中HCl的质量相等 |
(3)经计算3g镁和100g质量分数7.3%的盐酸充分反应可生成氢气0.2g,但经实验测定,生成氢气的质量大于0.2g,则可能的原因是过量的镁与 发生反应。

天然气是常见的化石燃料。
(1)做饭时,若燃气灶的火焰呈现黄色或橙色,锅底出现黑色,应将炉具的进风口调 (填"大"或"小")。
(2)含160g甲烷的天然气充分燃烧,生成二氧化碳的质量是多少克?(根据化学方程式进行计算)
"千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。"这是明代民族英雄于谦的传世之作,蕴含着丰富的化学知识。诗中描绘的烧制熟石灰及其应用过程如图所示:

(1)图中石灰石、生石灰、熟石灰三种物质共同含有的元素为 (填符号);
(2)图中所涉及的物质中由离子构成的是 (只填一种物质的化学式);
(3)虎门销烟时,林则徐把鸦片和生石灰共同投入水池销毁,简述其中的化学原理 ;
(4)写出图中所示过程中④的化学方程式 ;
(5)碳酸钙在高温下分解为氧化钙和二氧化碳,其中各物质的质量关系可用如图表示:

则生成二氧化碳的质量占 %。
金属在生产和生活中有着广泛应用。
(1)下列金属制品在应用中,利用金属导热性的是 。
a.金属硬币 b.铜制火锅 c.铝制导线
(2)铝比铁活泼,但铝在空气中比铁稳定,其原因是 。
(3)工业上用盐酸除去钢板表面上的锈要严格控制盐酸的用量,用量过多会发生反应而损坏钢板,用化学方程式表示损坏钢板的反应 。
(4)高铁的迅速发展对钢轨的需求量越来越大,质量要求越来越高。工业上经常用“铝热反应”来焊接钢轨,其原理是:  ,该反应的基本类型是 反应;若焊接钢轨需要50.4kg铁,理论上需要铝的质量是 kg。
,该反应的基本类型是 反应;若焊接钢轨需要50.4kg铁,理论上需要铝的质量是 kg。
如图是某胃药标签说明书。

(1)若用碳酸镁代替碳酸氢钠,则每次用量需减少。请解释其中的道理 。
(2)此胃药不适用于胃溃疡患者,其原因是什么? 。
高纯度的氧化钙是电子工业中的重要原料.用优质的大理石(主要成分是CaCO3)制备高纯度的氧化钙的流程如图:
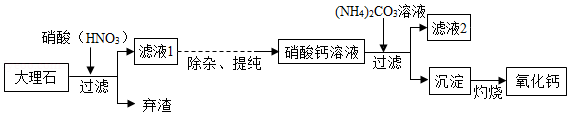
回答下列问题:
(1)大理石与硝酸反应的化学方程式是 .
(2)加入 (NH4)2CO3溶液时发生反应的化学方程式是 .
(3)将滤液2经过 、冷却结晶、过滤,得到氮肥晶体.
(4)含CaCO3的质量分数90%的大理石1000kg经过上述流程,若不考虑钙元素的损失,理论上可以得到氧化钙 kg.
根据化学方程式进行计算:
多少二氧化碳能与含有8g溶质的氢氧化钠溶液完全反应生成碳酸钠?
目前,人们使用的燃料大多来自于化石燃料.
(1)化石燃料有煤、 和天然气等,它们是 (填“可”或“不可”)再生资源.
(2)某工厂每天燃烧的煤含硫0.16t,根据化学方程式计算该工程每天生产的二氧化硫的质量是多少?
(3)二氧化硫直接排放到空气中会造成空气污染,若遇降雨会形成 ,取这种刚降到地面的雨水水样,在一段时间内每隔几分钟测一次PH值,其PH值会逐渐减小,这说明在测定期间酸性会 .
金属材料在生产、生活中应用广泛。
(1)由于金属铜具有良好的 ,常用于制作导线。
(2)铁制品锈蚀的过程,实际上是铁与 等发生化学反应的过程。工业上常用稀盐酸除去铁制品表面的锈,该反应的化学方程式是 。
(3)某工厂排放的废液中含有硫酸亚铁和硫酸。取一定量的废液样品,加入过量的铁粉,充分反应后其中的溶质是 ;反应后所得溶液的质量与反应前相比 。(选填“增大”、“减小”或“无法判断”)。
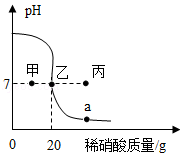
常温下,一锥形瓶中盛有20g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加溶质质量分数为6.3%的稀硝酸,用pH传感器测得溶液的pH与加入稀硝酸的关系曲线如图。请回答问题:
(1)本实验反应的化学方程式是 。
(2)pH=7时,锥形瓶中的溶液呈 色,此时溶液的溶质质量分数是 (结果精确到0.01%)。
(3)图中a点对应的溶液中溶质的化学式是 。
(4)若改用溶质质量分数为12.6%的稀硝酸进行本实验,pH传感器测得的曲线可能经过
(填“甲”“乙”或“丙”)点。
将一定质量的铝和铁的粉末放入硝酸镁和硝酸银的混合溶液中,充分反应后过滤,所得溶液质量与反应前溶液质量相比 (填"变大"、"变小"或"不变"),滤液中一定含有的阳离子 (写离子符号);向滤渣中加入稀盐酸,如果有气泡产生,滤渣中一定有 。
以黄铁矿(主要成分为FeS 2)为原料生产硫酸的工艺流程如图所示:
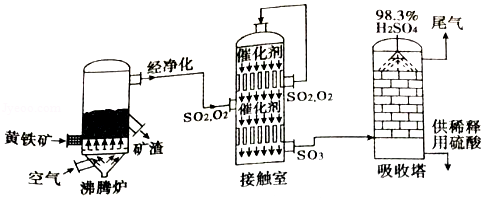
(1)沸腾炉中发生反应的化学方程式为:4FeS 2+11O 2 2X+8SO 2,其中X的化学式为 。
(2)接触室中发生反应的化学方程式为:2SO 2+O 2 2SO 3,产物SO 3中硫元素的化合价为 ;吸收塔中发生反应的化学方程式为:SO 3+H 2O═H 2SO 4,该反应的基本类型是 。若有800kg三氧化硫进入吸收塔中,且完全被吸收,则理论上制得硫酸的质量为 kg。
(3)O 2、SO 2、SO 3、H 2SO 4四种物质中属于氧化物的是 。
(4)实验室中稀释浓硫酸的操作是 。
2013年12月2日,“嫦娥三号”探测器由“长征三号乙”运载火箭发射,首次实现月球软着陆和月面巡视勘察。
(1)“长征三号乙”运载火箭的第三级采用燃料是液氢、助燃剂是液氧。 液氢燃烧的化学方程式为_____ __,液氢应用于航天领域的优点是_______________。氢能源是最理想的燃料,目前广泛使用还存在困难,如:___________________(写一个)。
(2)“长征三号乙”运载火箭的一、二级火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作推进剂,两者反应的化学方程式为C2H8N2 +2N2O4 =3N2 ↑+2CO2↑+4H2O↑。
根据化学方程式计算:12 t C2H8N2完全燃烧需要助燃物N2O4的质量.(写出解题过程)(计算结果保留一位小数)
(3)“嫦娥三号”的“玉兔”月球车可从携带的锂电池储备一定的能源。锂电池的工作原理是锂与二氧化锰反应生成LiMnO2,从能量变化角度看,该反应将化学能转化为 。