铅蓄电池在生产、生活中使用广泛。其构造示意图如图1,回答下列问题:

(1)铅蓄电池充电时是将电能转化为 (填序号)。
a、机械能 b、热能 c、化学能
(2)铅蓄电池放电过程中,反应的化学方程式为Pb+PbO 2+2H 2SO 4═2PbSO 4+2H 2O,据此可知,铅蓄电池在放电时,溶液的pH不断 (填"增大"、"减小"或"不变")。
(3)如图2是回收废铅蓄电池的一种工艺流程:
①从材料分类角度看,塑料是一类 材料。
②废硫酸可以与氟磷灰石[Ca 5(PO 4) 3F]反应,反应的化学方程式为2Ca 5(PO 4) 3F+7H 2SO 4═3CaSO 4+3Ca(H 2PO 4) 2+2HF,反应产物中可用作化肥的物质是 。
③如表是一些金属熔点的数据:
| 金属 |
锡 |
铅 |
铋 |
镉 |
| 熔点∕℃ |
231.9 |
327.5 |
271.3 |
320.9 |
日常所用保险丝由铋、铅、锡、镉等金属组成,其熔点约为 (填序号)
A.300﹣320℃
B.230﹣250℃
C.60﹣80℃
D.20﹣40℃
④废硫酸直接排放会污染环境,拟选用如表物质中和后再排放:
| 物质 |
CaCO 3 |
Ca(OH) 2 |
NH 3 |
NaOH |
| 市场参考价(元/kg ) |
1.8 |
2.0 |
6.5 |
11.5 |
已知:2NH 3+H 2SO 4═(NH 4)SO 4,如果要求花最少的钱来中和等质量、等浓度的废硫酸,则应选择 (填序号)。
a、CaCO 3 b、Ca(OH) 2c、NH 3d、NaOH。
氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe 2O 4)可用于循环分解水制氢,其反应可表示为:
6ZnFe 2O 4 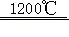 6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O
6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O 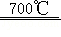 3ZnFe 2O 4+H 2↑
3ZnFe 2O 4+H 2↑
(1)ZnFe 2O 4中Fe的化合价为 。
(2)该循环制氢中不断消耗的物质是 (填化学式),得到H 2和O 2的质量比为 。
(3)氢气作为新能源的优点有 (任写一点)。该循环法制氢的不足之处是 。
Ⅱ.贮氢:合金Mg 2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg 2Cu+3H 2 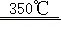 3MgH 2+MgCu 2
3MgH 2+MgCu 2
(4)熔炼制备Mg 2Cu合金时,通入氩气的目的是 。
(5)氢化物MgH 2与水反应生成一种碱,并释放出H 2. 其化学反应方程式为 。
(6)11.2g Mg 2Cu完全吸氢后所得混合物与过量盐酸反应,放出H 2的质量为 g。
如图所示是实验室制取气体的常用仪器,回答下列问题。

(1)标号为e的仪器名称是 。
(2)用2KMnO 4 K 2MnO 4+MnO 2+O 2↑制取 O 2,并用向上排空气法收集。
①若制取3.2gO 2,理论上至少需要KMnO 4 g;
②检验O 2收集满的方法是 ;
(3)用大理石和稀盐酸反应制取CO 2,并用排空气法收集;
①该反应的化学方程式为 ;
②组装制取装置时,需选择上图中的a、b、h、i、j、m和 。
碳酸钙、碱石灰(NaOH和CaO的混合物)等作为吸收剂可以对燃煤烟气进行脱硫处理,利用数字化实验可以来测定燃煤烟气中SO2的含量,得到如图所示的SO2含量与时间的关系曲线图
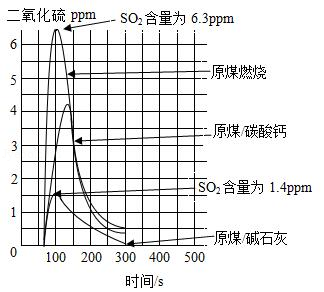
(1)由图可知,脱硫效率较高的吸收剂是 (填名称)。
(2)实验时,称取的3份原煤的质量要相等,其目的是 。
(3)利用碳酸钙吸收SO2转化为CaSO3,CaSO3与空气中O2反应转化为CaSO4.写出CaSO3转化为CaSO4的化学方程式 。
(4)利用碱石灰吸收SO2时,下列措施能使脱硫效率提高的是 (填序号)
a.将原煤与碱石灰粉碎,混合均匀
b.将碱石灰的用量适当增加
c.将时间300s变为500s
(5)利用碱石灰吸收1.28gSO2时,碱石灰中的NaOH、CaO与SO2反应转化为Na2SO3和CaSO3,则理论上反应消耗碱石灰的质量(m)范围是 。
如图装置可用于实验室制取常见的气体
(1)仪器A的名称是 ;气球的作用是 .
(2)制取O2.Y是 ;实验时,气球先变大,后变小.先变大的原因有:①反应生成了气体,气体进入气球;② .
(3)制取CO2.写出有关反应的化学方程式 .
(4)制取H2.现取足量的粗锌加入到25g稀硫酸中,充分反应后,产生0.1g氢气,则所用稀硫酸中溶质的质量分数为多少?(写出计算过程)

如图是实验室制取气体的常用装盆,请回答下列问题:

(1)写出图中标号仪器的名称:a 、b .
(2)实验室可加热KMnO 4固体制取O 2:
①请写出该反应的化学方程式 ;
②如A所示,加热一段时间后,某同学发现试管口未放置棉花团,应采取的正确操作: ,再组装好仪器继续实验.
(3)实验室可用锌粒与稀硫酸反应制取H 2,请写出该反应的化学方程式: ,应选用的装置是 (填字母).
(4)实验室选用C装置制取CO 2的化学方程式:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑
请计算:
①CO 2的相对分子质量是 ;
②现需收集4 瓶(每瓶0.125L) CO 2气体(实验条件下CO 2的密度为2g•L ﹣ 1),其质量是 g;
③收集上述CO 2至少需要大理石(含CaCO 38O%)的质量是 g (精确到0.1g).
根据如图回答问题。

(1)仪器①的名称是 。
(2)实验室用氯酸钾制取氧气的化学方程式为 。所选用的收集装置是E或 (填字母序号,下同)。
(3)实验室用大理石和稀盐酸制取二氧化碳,所选用的发生装置是 。收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到 ,说明瓶中已充满二氧化碳。
(4)某同学用较浓的盐酸制取氢气,若要制取并收集一瓶较纯净的氢气,则装制连接顺序序号为 。
(5)实验室制取2g氢气,理论上应取锌的质量是 g。
为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),进行了如下实验:

请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 。
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质质量(x)的比例式 。
(3)此镁样品中镁的质量分数为 。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,所需浓盐酸的质量为 。
(5)若将反应后的滤液蒸发104.4 g水,无晶体析出,所得溶液中溶质的质量分数为 。
(6)若要生产含镁4.5%的铝合金960 t,需要上述金属镁样品的质量为 。
水和溶液在生产,生活中具有广泛的用途。
(1)下列物质属于溶液的是 (填字母)。
A.医用酒精
B.植物油和水的混合物
C.蒸馏水
D.糖水和食盐水的混合物
(2)甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示。

①t1℃时,甲物质的溶解度是 。
②t2℃时,分别将甲、乙固体溶于水,配成两种物质的饱和溶液各100g,所需水的质量相比,甲 乙(填“大于”“小于”或“等于”)。
(3)如图中甲、乙、丙、丁、戊是五种不同类别的物质,且分别属于单质、氧化物、酸、碱盐中的一种。相连物质之间均能在一定条件下发生化学反应,且生成物之一为水。

①当丁为氢氧化钠、戊为氯化铵时,甲、乙、丙的化学式依次可能是 (只写一组),其中丙和丁发生中和反应的化学方程式为 ;乙和丙反应的化学方程式为 。
②若要鉴别氯化铵和氯化钾固体,通常可采用的方法是 。
(4)中国天宫空间站预计2022年建成。空间站获取氧气的主要方式是电解水,写出电解水的化学方程式 ,并计算若得到16kg的氧气,理论上最少消耗水的质量是多少?