"加氢几分钟,畅行数百里",这是2021上海车展上为氢能源汽车打出的标语。氢能源汽车使用的是氢燃料电池(如图所示)。电池工作时在催化剂的作用下,氢原子失去电子形成氢离子,穿过电极A通过电解液移动到电极B与氧离子结合形成水分子;而电子则从电极A经外部电路通过电动机  到达电极B,形成电流。
到达电极B,形成电流。
(1)氢燃料电池工作时是将化学能直接转化为 能。
(2)氢气是氢燃料电池的原料,可以在用电低谷时,利用电网多余电能电解水来制取。已知1.2kg氢气大约可供某款氢能源汽车行驶100km,请根据化学方程式计算,制取1.2kg氢气至少需要电解多少质量的水。
(3)氢燃料电池工作时,通过电动机的电流方向是: 。
(4)世界能源组织提出:在制氢过程中基本上没有碳排放而得倒的氢气称为绿氢。下列方式可制得绿氢的是 。
| A. |
水力发电制氢 |
| B. |
太阳能发电制氢 |
| C. |
火力发电制氢 |
| D. |
核能发电制氢 |

含有镁的合金广泛应用于航空航天领域,回答下列问题:
(1)取少量光亮的镁条于试管中,向其中加入稀盐酸,观察到 的现象可推断二者发生了化学反应。
(2)若验证镁与稀盐酸反应后的溶液中有盐酸剩余,下列实验设计可行的是 。
A.取生锈的铁钉于试管中,加入反应后的溶液
B.取少量反应后的溶液于试管中,滴加AgNO3溶液
C.取少量反应后的溶液于试管中,滴加稀氢氧化钠溶液
(3)向镁条中加入过量稀盐酸,完全反应后,再加入过量氢氧化钠溶液,生成5.8g氢氧化镁沉淀。
①写出加入氢氧化钠溶液时,生成氢氧化镁沉淀的化学方程式 ;
②计算镁条与稀盐酸完全反应后生成MgCl2的质量为 g。
阅读下列短文并回答问题。
氢在太阳中的核聚变放出大量光和热,是太阳能的来源,掌握可控核聚变技术对人类未来文明发展至关重要。2021年5月,中科院“人造太阳”EAST实验装置创造了氘、氚核聚变在1.2亿摄氏度下运行101秒的新纪录,为世界核聚变研究的发展作出巨大贡献。
氢气是高热值清洁燃料,目前主要通过电解水和天然气重整的方法获取氢气,其中天然气重整制氢的一种原理为:CH4+H2O CO+3H2,CO+H2O
CO+3H2,CO+H2O CO2+H2。氢氧燃料电池已被用作汽车驱动电源,H2和O2在电池内部(含有H2SO4或KOH等物质的溶液)发生反应产生电能。另外,CH4、C2H5OH等也可用作燃料电池的燃料,它们在燃料电池中的反应本质上与它们在O2中的燃烧相同。
CO2+H2。氢氧燃料电池已被用作汽车驱动电源,H2和O2在电池内部(含有H2SO4或KOH等物质的溶液)发生反应产生电能。另外,CH4、C2H5OH等也可用作燃料电池的燃料,它们在燃料电池中的反应本质上与它们在O2中的燃烧相同。
原子名称 |
质子数 |
中子数 |
核外电子数 |
氘(dao) |
1 |
1 |
1 |
氚(chuān) |
1 |
2 |
1 |
(1)氘、氚原子的构成如表,它们都属于氢元素的原因是 相同。
(2)上述短文出现的物质中,属于碱的是 (填化学式)。
(3)电解18g H2O理论上能获得 g H2。
(4)上述天然气重整制氢原理的两个反应中,化合价保持不变的元素是 。
(5)燃料电池工作时H2SO4溶液中起导电作用的离子是 (填化学符号)。
(6)CH4在O2中充分燃烧的化学方程式是 。
氢气是中学化学的重要试剂,可以与Fe 2O 3、CuO等多种金属氧化物反应得到金属单质.某化学兴趣小组利用白铁(表面镀锌的铁)加工业的下脚料制取氢气,生成的氢气与CuO反应,其反应装置如图:(部分夹持装置省略)
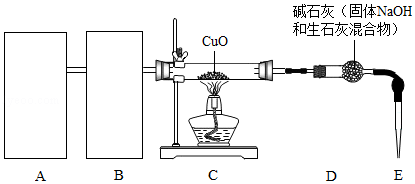
(1)从下图a、b、c中选择一套制取氢气的最佳装置 置于A处.
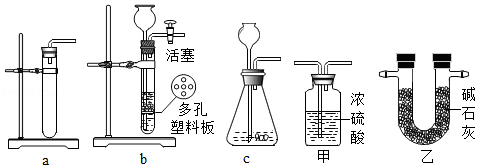
(2)该小组若选用盐酸和白铁片反应制取氢气,请为B处从上图甲和乙中选择一套合适的除杂装置 .
(3)检验装置气密性之后,点燃C处酒精灯之前必须进行的步骤是 .
(4)若称取CuO的质量为m 1g,反应一段时间后C处药品完全变为紫红色,此时停止加热,继续通入氢气至药品冷却,称量D装置,质量增加了m 2g,则m 1和m 2应满足的关系是 .(忽略其他因素带来的误差)
铅蓄电池在生产、生活中使用广泛。其构造示意图如图1,回答下列问题:

(1)铅蓄电池充电时是将电能转化为 (填序号)。
a、机械能 b、热能 c、化学能
(2)铅蓄电池放电过程中,反应的化学方程式为Pb+PbO 2+2H 2SO 4═2PbSO 4+2H 2O,据此可知,铅蓄电池在放电时,溶液的pH不断 (填"增大"、"减小"或"不变")。
(3)如图2是回收废铅蓄电池的一种工艺流程:
①从材料分类角度看,塑料是一类 材料。
②废硫酸可以与氟磷灰石[Ca 5(PO 4) 3F]反应,反应的化学方程式为2Ca 5(PO 4) 3F+7H 2SO 4═3CaSO 4+3Ca(H 2PO 4) 2+2HF,反应产物中可用作化肥的物质是 。
③如表是一些金属熔点的数据:
| 金属 |
锡 |
铅 |
铋 |
镉 |
| 熔点∕℃ |
231.9 |
327.5 |
271.3 |
320.9 |
日常所用保险丝由铋、铅、锡、镉等金属组成,其熔点约为 (填序号)
A.300﹣320℃
B.230﹣250℃
C.60﹣80℃
D.20﹣40℃
④废硫酸直接排放会污染环境,拟选用如表物质中和后再排放:
| 物质 |
CaCO 3 |
Ca(OH) 2 |
NH 3 |
NaOH |
| 市场参考价(元/kg ) |
1.8 |
2.0 |
6.5 |
11.5 |
已知:2NH 3+H 2SO 4═(NH 4)SO 4,如果要求花最少的钱来中和等质量、等浓度的废硫酸,则应选择 (填序号)。
a、CaCO 3 b、Ca(OH) 2c、NH 3d、NaOH。
氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe 2O 4)可用于循环分解水制氢,其反应可表示为:
6ZnFe 2O 4 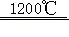 6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O
6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O 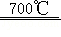 3ZnFe 2O 4+H 2↑
3ZnFe 2O 4+H 2↑
(1)ZnFe 2O 4中Fe的化合价为 。
(2)该循环制氢中不断消耗的物质是 (填化学式),得到H 2和O 2的质量比为 。
(3)氢气作为新能源的优点有 (任写一点)。该循环法制氢的不足之处是 。
Ⅱ.贮氢:合金Mg 2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg 2Cu+3H 2  3MgH 2+MgCu 2
3MgH 2+MgCu 2
(4)熔炼制备Mg 2Cu合金时,通入氩气的目的是 。
(5)氢化物MgH 2与水反应生成一种碱,并释放出H 2. 其化学反应方程式为 。
(6)11.2g Mg 2Cu完全吸氢后所得混合物与过量盐酸反应,放出H 2的质量为 g。
如图所示是实验室制取气体的常用仪器,回答下列问题。

(1)标号为e的仪器名称是 。
(2)用2KMnO 4 K 2MnO 4+MnO 2+O 2↑制取 O 2,并用向上排空气法收集。
①若制取3.2gO 2,理论上至少需要KMnO 4 g;
②检验O 2收集满的方法是 ;
(3)用大理石和稀盐酸反应制取CO 2,并用排空气法收集;
①该反应的化学方程式为 ;
②组装制取装置时,需选择上图中的a、b、h、i、j、m和 。
碳酸钙、碱石灰(NaOH和CaO的混合物)等作为吸收剂可以对燃煤烟气进行脱硫处理,利用数字化实验可以来测定燃煤烟气中SO2的含量,得到如图所示的SO2含量与时间的关系曲线图
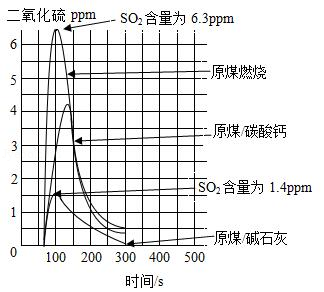
(1)由图可知,脱硫效率较高的吸收剂是 (填名称)。
(2)实验时,称取的3份原煤的质量要相等,其目的是 。
(3)利用碳酸钙吸收SO2转化为CaSO3,CaSO3与空气中O2反应转化为CaSO4.写出CaSO3转化为CaSO4的化学方程式 。
(4)利用碱石灰吸收SO2时,下列措施能使脱硫效率提高的是 (填序号)
a.将原煤与碱石灰粉碎,混合均匀
b.将碱石灰的用量适当增加
c.将时间300s变为500s
(5)利用碱石灰吸收1.28gSO2时,碱石灰中的NaOH、CaO与SO2反应转化为Na2SO3和CaSO3,则理论上反应消耗碱石灰的质量(m)范围是 。
如图装置可用于实验室制取常见的气体
(1)仪器A的名称是 ;气球的作用是 .
(2)制取O2.Y是 ;实验时,气球先变大,后变小.先变大的原因有:①反应生成了气体,气体进入气球;② .
(3)制取CO2.写出有关反应的化学方程式 .
(4)制取H2.现取足量的粗锌加入到25g稀硫酸中,充分反应后,产生0.1g氢气,则所用稀硫酸中溶质的质量分数为多少?(写出计算过程)

如图是实验室制取气体的常用装盆,请回答下列问题:

(1)写出图中标号仪器的名称:a 、b .
(2)实验室可加热KMnO 4固体制取O 2:
①请写出该反应的化学方程式 ;
②如A所示,加热一段时间后,某同学发现试管口未放置棉花团,应采取的正确操作: ,再组装好仪器继续实验.
(3)实验室可用锌粒与稀硫酸反应制取H 2,请写出该反应的化学方程式: ,应选用的装置是 (填字母).
(4)实验室选用C装置制取CO 2的化学方程式:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑
请计算:
①CO 2的相对分子质量是 ;
②现需收集4 瓶(每瓶0.125L) CO 2气体(实验条件下CO 2的密度为2g•L ﹣ 1),其质量是 g;
③收集上述CO 2至少需要大理石(含CaCO 38O%)的质量是 g (精确到0.1g).
根据如图回答问题。

(1)仪器①的名称是 。
(2)实验室用氯酸钾制取氧气的化学方程式为 。所选用的收集装置是E或 (填字母序号,下同)。
(3)实验室用大理石和稀盐酸制取二氧化碳,所选用的发生装置是 。收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到 ,说明瓶中已充满二氧化碳。
(4)某同学用较浓的盐酸制取氢气,若要制取并收集一瓶较纯净的氢气,则装制连接顺序序号为 。
(5)实验室制取2g氢气,理论上应取锌的质量是 g。
为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),进行了如下实验:

请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 。
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质质量(x)的比例式 。
(3)此镁样品中镁的质量分数为 。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,所需浓盐酸的质量为 。
(5)若将反应后的滤液蒸发104.4 g水,无晶体析出,所得溶液中溶质的质量分数为 。
(6)若要生产含镁4.5%的铝合金960 t,需要上述金属镁样品的质量为 。