“火”的掌控和应用不断推进人类文明的发展。
(1)古人“钻木取火”时“钻木”是为了 (答燃烧的条件);
(2)“长征火箭”燃料燃烧的化学方程式为:C2H8N2+2N2O4 2CO2+4H2O+3X,则X的化学式是 。
2CO2+4H2O+3X,则X的化学式是 。
为了测定某铜、锌合金的组成,称取10g该合金粉末,在粉末中连续6次加入稀硫酸反应,每加一次稀硫酸,记录完全反应后所得剩余固体的质量,实验数据如下:
| |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
| 加入稀硫酸的质量(g) |
10 |
10 |
10 |
10 |
10 |
10 |
| 剩余固体的质量(g)[ |
8.7 |
7.4 |
6.1 |
4.8 |
3.5 |
3.5 |
(注意:以下各题,只要求填写计算结果,不要求写计算过程)
(1)据表中数据,计算该合金中锌的质量为 ;
(2)计算所加稀硫酸的溶质的质量分数为 (精确到0.1%);
(3)计算恰好完全反应后所得溶液的溶质的质量分数为 (精确到0.1%)。
(10分)某学校化学兴趣小组的同学想测定赤铁矿中氧化铁的含量,做了如下实验:首先称取100 g该赤铁矿样品放入烧杯中,然后将500g的稀盐酸分5次加入烧杯内(假设其余杂质均不与盐酸反应也不溶于水)进行充分反应.实验过程中的数据记录如下:
| |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
| 稀盐酸的质量 |
100g |
100g |
100g |
100g |
100g |
| 溶液的质量 |
116.0g |
X |
348.0g |
464.0g |
575.0g |
请回答下列问题:
(1)该小组要用质量分数为36.5%浓盐酸配制所需的500g的稀盐酸,则需浓盐酸的质量为_____
(2)写出实验中发生反应的化学方程式____________________
(3)列出求解生成氯化铁总质量的比例式____________________
(4)将第二次反应后所得溶液蒸发掉32g水(未达到饱和),则所得溶液的溶质质量分数是________
(5)某工厂要想制得420t含杂质3%的生铁,需要这种赤铁矿的质量为___________
(1)自然界中吸收大气中CO2的环节是 .
(2)由于人类消耗化石燃料的增加和森林的乱砍滥伐,使空气中CO2的含量上升,从而导致温室效应增强,全球气候变暖.请写出一条因气候变暖给人类生存环境带来影响的情况: .
(3)科学家研究得到:海洋是吸收大量CO2的地方.如果工业生产产生的CO2排放量继续增加,海洋将被“酸化”.请写出酸化原因的化学方程式 。
(4)科学家目前正在研究将空气中过量的CO2和H2在催化剂和适量条件下转化成液态甲醇和水,反应的化学方程式:CO2+3H2 甲醇+H2O.则甲醇的化学式是 .
甲醇+H2O.则甲醇的化学式是 .
实验室常用锌块和稀盐酸反应制取氢气,若用6.5克锌和稀盐酸反应。则:
(1)可制取氢气 g。
(2)若用36.5﹪的盐酸配制稀盐酸,至少需要36.5﹪的盐酸 g。
某燃料X在7.2g氧气中燃烧,得到9.2g混合气体(可能含有一氧化碳、二氧化碳、水蒸气)。化学兴趣小组的同学利用下图所示装置验证混合气体的成分。
资料:①浓硫酸具有吸水性。②浓氢氧化钠溶液能吸收二氧化碳。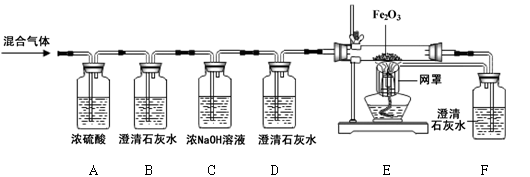
(1)通过混合气体后,A装置增重4.5g,说明混合气体中含有________________________。
(2)B装置中澄清石灰水变浑浊,发生反应的化学方程式为 。D装置的作用是 。
(3)当观察到 ,证明混合气体中有CO。
(4)实验结束后,同学们称量B、C装置共增重3.3g,根据以上数据可确定燃料X中所含元素及元素质量比为_________________。
学习化学使我们思维更严谨。下图a是钨元素在元素周期表中的信息,图b是
硫原子的原子结构示意图,图C为元素周期表的一部分,①-⑤代表五种不同种元素。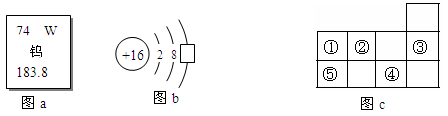
(1)图a中183.8表示钨元素的 ,W元素的原子序数是 ;
(2)图b方框内的数字是 ;
(3)有关图C的说法,正确的有 (填序号);
A.原子序数:③>②
B.核外电子数:①=⑤
C.④与⑤处在同一周期
(4)用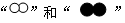 分别代表两种不同的分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
分别代表两种不同的分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
请回答下列问题:
①上图所表示的物质中,属于混合物的是 (写图示编号);
②该反应的基本反应类型为 ;
③已知A2的相对分子质量为2,B2的相对分子质量为28,若要使3g A2完全反应,则需要B2的质量是 。
用 和
和 分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下: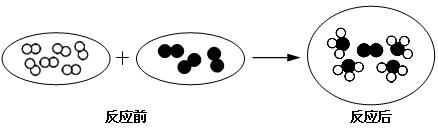
(1)参加反应的B2与生成物分子的个数比为 ;
(2)已知 的相对原子质量是
的相对原子质量是 的m倍,则参加反应的A2与生成物的质量之比为______________;
的m倍,则参加反应的A2与生成物的质量之比为______________;
(3)生成物的化学式为 (用A、B表示).
下图是“×××钙片商品标签图”,根据标签内容信息回答下列问题:(结果精确到0.1)
| ×××儿童咀嚼片 (60片装) |
| [主要成分]碳酸钙,维生素D [规格]2.5g/片,每片中含碳酸钙≥1.24g,维生素D100IU [食用方法]嚼食,每天一片 [功效]补钙 |
(1)主要成分碳酸钙中钙元素的质量分数为__________,每片中至少含钙元素的质量为______________g。
(2)小红同学为测定其碳酸钙的含量标注是否属实,她取出4片钙片,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g。称量烧杯中剩余物为47.8g(不含烧杯质量,假定钙片其他成分不与稀盐酸反应)。
试计算:①生成二氧化碳的质量____________;
②稀盐酸中溶质的质量分数____________;
③通过计算判断钙片中碳酸钙的含量标注是否属实________________。
如图所示,将一定量氧化铜与碳的混合物加热。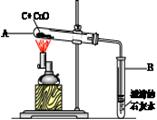
在加热过程中,记录A中固体质量变化如下表,在100秒后停止加热。
| 加热时间(s) |
0 |
60 |
80 |
90 |
100 |
| A中固体质量(g) |
9.6 |
9.6 |
8.6 |
7.4 |
7.4 |
①0—60秒内固体质量不变,原因是 (12) ,但导管口已有气泡冒出,该气泡是 (13) (填“空气”、“氧气”或“二氧化碳”);实验中说明化学反应发生的现象是 (14) ;选择100秒后停止加热的理由是 (15) 。
② 反应共生成 (16) 克二氧化碳。
③ 计算参加反应的氧化铜的物质的量(请根据化学方程式列式计算)
请根据下图实验装置图回答问题: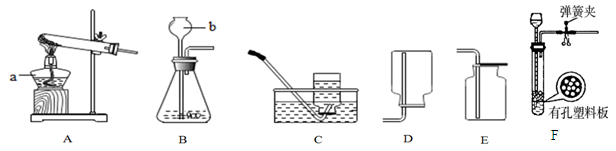
(1)写出仪器a,b的名称:a是 ,b是 .
(2)用A装置制取氧气的化学方程式是 ,可选用的收集装置是 (填序号).
(3)实验室用B、E装置制取CO2的化学方程式为 ,请写出用澄清石灰水检验二氧化碳时发生反应的化学方程式: 。若将发生装置由B改为F,其优点是 。
(4)将一瓶二氧化碳气体正立于烧杯中(装置见下图),敞口一会儿,集气瓶外壁上湿润的蓝色石蕊试纸自上面而下变红色,该现象说明分子具有 的性质,还说明二氧化碳气体 .
(5)某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表:
①计算石灰石样品中CaCO3的质量分数。
②若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能 (填“偏大”、“偏小”或“准确”),原因是 。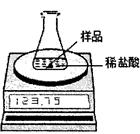
理解、掌握质量守恒定律是学好化学的基础。
(1)某同学按图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,请你用质量守恒定律解释其原因是 ;发生反应的化学方程式是 。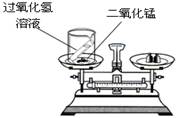
(2)由质量守恒定律可知,在化学反应前后,一定不变的是 (填序号)。
①分子种类 ②原子种类 ③分子数目
④原子数目 ⑤物质质量 ⑥元素种类
(3)4.14玉树地震给当地人民造成巨大损失。为防止灾后发生疫情,必须对灾区进行消毒,其中的一种消毒剂是漂白粉,它的有效成分是次氯酸钙[Ca(ClO)2],次氯酸钙能与水和二氧化碳发生反应,请完成这个反应的化学方程式: Ca(ClO)2 +CO2 + H2O=CaCO3↓+2 。
(4)A、B、C三种物质各15 g,它们化合时只生成30 g新物质D。若增加10 g A,则反应停止后,原反应物中只剩余B。根据上述条件推断下列说法中正确的是 (填字母)。
A.该反应中,B是催化剂
B.第一次反应停止后,C剩余9g
C.第二次反应后,D的质量为50 g
D.反应中A和B的质量比是5∶2
E.反应中A和C的质量比是5∶2
使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放。
(1)镁元素在自然界中是以(填"单质"或"化合物")形式存在。
(2)工业制镁的一种原理是
↑,抽走容器中的空气对反应有促进作用,且能防止空气中的物质与
反应使产品混有(填化学式)。
(3)制镁的原料
可从海水中获得。小华利用镁与盐酸反应后的废液,模拟从海水中获取
的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入
,至
完全沉淀为止,过滤得
固体。共消耗8.4
。
步骤2:将
固体加热分解为
和水,所得
的质量为4.0
。
①步骤2中
分解的化学方程式为。
②通过所得
的质量计算上述废液中含
的质量
。
③分析实验数据,可知步骤Ⅰ中反生的化学反应有:
;
↓;。